Son yüzyılda tıp, bir hekimden diğerine aktarılan uygulama standartlarının, kişisel tecrübelerin temeline dayandırıldığı iyileştirme sanatından, bilimsel metoda bağlı itinalı zihinsel disiplin olmasına kadar çarpıcı bir şekilde gelişmiştir. Bir hipotez veya tahminin deneme yoluyla geçerliliğini test eden bir yöntem olan bilimsel metod, psikoloji, mikrobiyoloji, biyokimya ve farmakoloji alanlarında önemli ilerlemelere sebep olmaktadır. Bu ilerlemeler, 20. yüzyıl boyunca ortak kullanımla hekimlerin hastalıklara tanısal ve tedavi edici yaklaşımlarında bir temel olarak hizmet etmiştir.
1980’lerden itibaren genetiğin moleküler temelinin anlaşılması çarpıcı bir şekilde ilerlemiştir ve bu alandaki gelişmeler, kompleks genetik özelliklerin (örn., Hipertansiyon) temelinin yanında geleneksel hastalıkların (örn., Orak hücreli anemi) temelini tanımlayan yeni ve heyecan verici boyutlarını da belirlemektedir. Genler ve çevre arasındaki etkileşimin moleküler temeli de tanımlanmaya başlamıştır.
Çeşitli duyarlı ve özgül tekniklerle donanmış olan modern hekimler şimdi sadece kompleks patobiyolojik olayların moleküler temelini anlamaya başlamıyor aynı zamanda yaygın hastalıklar açısından risk altında bulunan bireyleri de teşhis edebiliyorlar. Bundan dolayı; modern tıbbı anlamak moleküler genetiği ve hastalıkların moleküler temelini anlamayı gerektirmektedir. Bu giriş bölümü, karmaşık ve hızla gelişen bu konunun genel bir tanımını vermekte ve bu metnin belirli bölümlerinde beIirtilecek olan moleküler tıbbın prensiplerini özetlemeye çalışmaktadır.
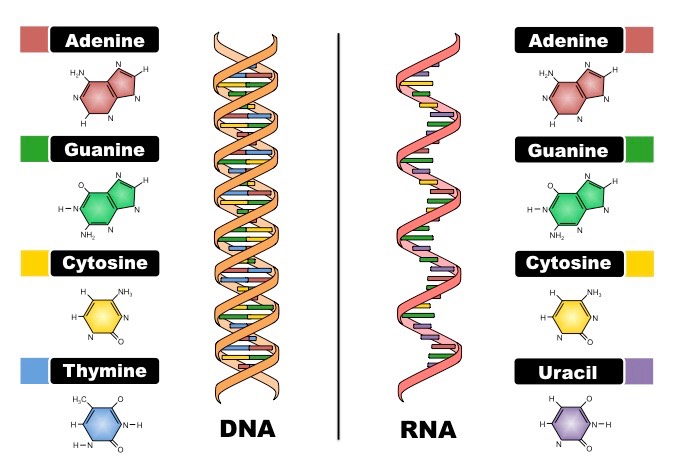
Tüm organizmalar türlerine ait hayati bilgilerini sonraki nesillere aktaran bir düzene sahiptir. Organizmanın genomunu oluşturan bir çift zincir deoksiribonükleik asit (DNA) polimeri, bu bilgileri şifrelemektedir. İnsan genomunda yaklaşık olarak 6 x109 nükletoid veya 3 x 109 çift nükletoid, çift heliks içerisinde birleşmektedir. DNA’nın özgül yapısının tümü, bu temel dizi tarafından belirlenir ve bu dizi, dizi hatalarının düzeltilmesini sağlayan ve hücre bölünmesi esnasında bilgilerin çoğaltılması için mekanik bir temel oluşturan çift heliksli bir yapı içerisinde diziye eşlenik form olarak depolanmaktadır.
Her bir DNA zinciri, replikasyon için bir kalıp olarak görev yapar ve bu duruma çift sarmal DNA’yı açan ve olağanüstü doğrulukla her bir zinciri kopyalayan DNA bağımlı DNA polimeraz hareketi eşlik eder. İnsan hücrelerinde her biri bir tek dizi ve bundan dolayı da tek genetik bilgi içeren 23 çift homozom bulunur. Gametositlerin haricindeki tüm hücre türleri, duplikedir, yani genetik yapı diploid sayıda genetik birimleri içerir, diploidin yarısı ise haploid sayı olarak isimlendirilir.
Kromozomların içerdiği genetik bilgiler, genler olarak bilinen farklı fonksiyonel parçalar içerisine ayrılır. Bir gen, genellikle özgül bir polipeptid dizisini kodlayan baz dizi birimi olarak tanımlanır. Yeni bilgiler, küçük, kodlama yapmayan RNA’ların bu önemli bilgilerin aktarımında önemli roller oynadığını ortaya koymaktadır. İnsan haploid genomunda tahminen 30.000 gen vardır ve bunlar protein kodlamayan ve fonksiyonları henüz bilinmeyen dizi bölgeleri arasında serpiştirilmiştir. Örneğin, kodlama yapmayan RNA’lar (örnek tRNA, rRNA, diğer küçük RNA’lar) ribozom ve splisozomlar gibi enzim kompleksierinin parçaları olarak görev yapmaktadırlar. Ortalama kromozom, 3000-5000 gen içerir ve bunlar büyüklük olarak yaklaşık 1 kilobazdan 2 Mb’ye kadar değişiklik göstermektedir.
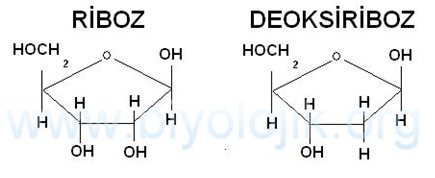
Transkripsiyon veya RNA sentezi, DNA içerisinde bulunan bilgiyi ınRNA olarak bilinen bir ara molekül türüne transfer etme yöntemidir. İki biyokimyasal fark RNA’yl D A’dan ayırır; polimerik omurga, fosfodiester bağlar ile bağlantılı olan deoksiribozdan ziyade ribozdan oluşur ve temel kompozisyon, timin yerine urasil kullanıldığı için farklıdır.
Bir DNA kalıbından RNA sentezi, her biri farklı nükleer lokalizasyon ve substrat özgüllüğüne sahip çok alt üniteli bir kompleks olan üç tip DNA bağımlı RNA polimeraz tarafından yapılır. Nükleolus içerisine yerleşmiş olan RNA polimerazı, ribozom içerisinde hem katalitik ve hem de yapısal fonksiyonlu moleküler bir yapı iskelesi oluşturarak 18S, 8S ve 28S ribozomal RNA’ları şifreleyen genlerin transkripsiyonunu düzenler.
Nükleolus yerine nükleoplazma içerisine yerleşmiş olan RNA polimeraz II öncelikle öncül RNA transkriptlerini ve küçük RNA molekülerini transkribe eder. RNA polimeraz lI’nin karboksil terminal ucu sadece, önemli serin ve threonin atıklarının protein fosforilasyonu tarafından enzim düzenlemesinin yapıldığı yer olan bir 220-kd protein alan ile değiştirilebilir. Tüm tRNA ve diğer rRNA moleküleri, nükleoplazmadaki RNA polimeraz III tarafından sentez edilir. RNA polimerazlar, makromoleküler kompleksler içerisinde ribozomal proteinlerle işlenip toplanmadan önce ilk olarak alt ünitelere ayrılması gereken öncü transkriptlerden sentez edilirler.
Ribozomal mjmari ve yapı bütünlüğü, kısa dubleks bölgeleri içeren bir dizı katlanabilen şekillerin bulunduğu rRNA 'nın sekonder ve tersiyer yapılarından alınır. Nükleuslar içerisindekı tRNA’nın öncülleri, S’cap bölgesinin çıkarılması, iç intron dizisinin kesilmesi ve terminal bölgelerin değişikliğine maruz kalır. mRNA öncüleri, ‘transkripsiyon’ adı verilen bir işlemde DNA çift heliksinin anlamlı zincirine benzeyen mRNA’nın tek bir zincirinin sentezini oluşturmak için DNA çift heliksinin ‘antisense’ (anlamsız) zincirini kopyalayan DNA bağımlı RNA polimeraz lI’nin hareketiyle nükleus içerisinde oluşturulur.
İlk immatur mRNA, ilk önce hem 5’ ve hem de 3’ uçlarında modifikasyona uğrar. Tap’ olarak adlandırılan özel bir nükletoid yapı, ribozoma bağlanmayı ve translasyonel etkiyi artırma görevini yapan 5’ucuna eklenir. 3’ ucu ise yaklaşık 20 nükleotidden oluşan, nükleaz kesimi ile modifikasyona uğrayan adenin bazının ardışık eklenmesi ile meydana gelen bir yapıdır. Bu yapı çoklu nükleotid (polinükleotid) dizisinden oluştuğu için poliA kuyruğu denir ve mRNA’nın kararlılığından sorumludur.
Tüm mRNA’larda daima aynı tarzda oluşan bu değişikliklere ek olarak, daha fazla diğer seçici değişiklikler de ortaya çıkabilir. Her bir genin, hem ekzonik ve hem de intronik dizileri olduğu ve öncü mRNA’lar ekzonintron sınırlarına dikkat etmeden transkribe edildiği için bu immatür mesaj, tüm ekzonları uygun dizide birbirine bağlayacak şekılde düzenlenmelidir. İmmatür mRNA’lar oluşturmak için intronik dizileri bağlama veya çıkarma işlemi, ara bir splisozom oluşumunu, küçük nükleer RNA’lardan oluşan büyük bir kompleks ve özgül proteinleri içeren çıkarılacak intronları içerisinde bulunduran bir ilmek veya kement benzeri bir yapı içeren zarifçe koreografisi yapılmış bir olaydır.
Sadece ATP hidrolizini gerektiren katalitik bir işlem olan kesip ekleme bittikten sonra olgun mRNA, nükleusdan, şifrelenmiş bilginin proteine çevrildiği sitoplazmaya geçebilir. Alternatif splicing (kesip-ekleme), doku özgüllüğü, gelişimsel ifade (ekspresyon) ve patolojik durumla belirlenen çok sayıda gen ürününü etkili bir şekilde üretme işlemidir. Gen kesip-eklenmesi, moleküler farklılığı genişleterek çoklu izoformların oluşumunu sağlar. İnsanlardakı genetik hastalıkların tahminen %30’u kesipeklemedekı defeklerden kaynaklanmaktadır. O zaman ortaya çıkan olgun RNA, baz kodunun polipeptide çevirme veya dönüştürme işlemjni başlatmak için nükleusdan ayrılır. Özgül genlerin alternatif kesip eklenme yolları (örn. alternatif ekzonik toplayıcı yolları) da transkripsiyonel düzenleme seviyesinde hizmet verir. Kendi kendinin yönettiği internal kesme (eksizyon) ve tamir kapasitesi olan katalitik RNA’nın keşfi, RNA’nın kendi başına genetik kodun çevrilmesi için hem kalıp ve hem de eş zamanlı bir şekilde enzim olarak görev yaptığı görüşünü ileri götürmüştür.
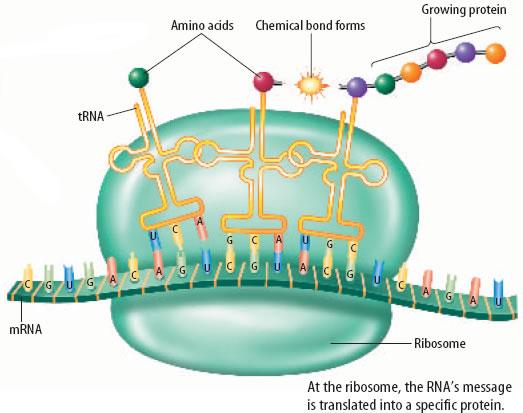
Protein sentezi ve mRNA kodunun translasyonu, sitoplazma içerisine yerleşmiş olan protein ve rRNA’nın makromoleküler kompleksieri olan ribozomlar üzerinde oluşur. Translasyon, üçlü baz dizisinin lineer kodunun (örneğin, kodon) aminoasite çevrilmesini sağlar. Dört bazlı bir kod, 64 muhtemel üçlü kombinasyon (4x4x4) oluşturur ve bunlar birçoğu, birden daha fazla baz üçlüsü tarafından kodlanan 20 farklı aminoasite tekabül eder ve mRNA’nın şifresini çözmek için uygun bir tRNA molekülü, taşıdığı üç bazlı antikodon ile çiftleşen tamamlayıcı baz sayesinde mRNA içerisindeki kodonu tanır; buna ek olarak, her bir tRNA antikodona tekabül eden bir tek aminoasitle yüklenir. mRNA kalıbı üzerindeki translasyon, rRNA’nın yardııruyla atlama olmaksızın aslında bir polipeptid polimerazı olan ve ribozom denilen bir montaj makinesi üzerinde ilerler. Koddaki dejenerasyon, mevcut tRNA molekül sayısını artırmasına, erken zincir sonlanması olasılığını azaltmasına ve tek bazlı mutasyonun potansiyel zafarlarını iyileştirmesine rağmen her 20 aminoasit için en azından bir tane RNA molekülü vardır. Daha sonra ribozomların enzimatik aktiviteleri, süreç içerisindeki tRNA’yı salarak bir peptit bağ senteziyle amino asitleri birleştirir.
Büyüyen polipeptid zinciri içerisindeki aminoasitlerin ardışık bağlantısı, nükleer DNA dizisi içerisinde bulunan bilgilerin olgun proteine dönüşmesindeki (DNA~ RNA ~ protein) son olayı temsil eder. Proteinler, organizmanın şekil ve fonksiyonundan doğrudan sorumludur. Bundan dolayı, primer aminoasit dizisi içerisindeki değişikliklerin sebep olduğu protein yapısı veya fonksiyonundaki anormallikleri, fenotipik değişikliklerin ve tanımlanabilen bazı hastalıkların nedenidirler. RNA sentezinin inhibisyonu, spesifik toksin ve antibiyotiklerin iyi bilinen bir mekanizmasıdır.
Zehirli mantarnların (örn., Amanita phalloides) yenmesiyle ortaya çıkan zehirlenme, RNA polimerazı inhibe eden ve RNA sentezinin devam etmesini bloke eden toksin alfa amanitinin salınmasına sebep olur. Antibiyotik antinomisin DNA , yüksek afinite ile çift zincirli DNA ile bağlanır ve DNA bağımlı RNA polimerazları ve transkripsiyonun seçici inhibisyonunun geçişini engelleyerek baz çiftler arasında anormal bağlanmalara sebep olur. Birkaç önemli antibiyotik translasyonun inhibisyonu yoluyla görevini yapar. Örneğin aminoglikozid antibiyotikler, antikodon etkileşimi olan mRNA-tRNA kodonun bozulması yoluyla görevini yapar, oysa ki eritromisin ve kloramfenikol ise peptip bağ oluşumunu inhibe eder.
GEN EKSPRESYONUNUN KONTROLÜ
Gen ekspresyonunun zamanlaması, süresi, yeri ve büyüklüğü, genomun idare ettiği hücre şekli ve fonksiyonunun kompleks yapısında önemli faktörlerdir. Gen ekspresyonu, DNA kalıbından mRNA transkriptlerine ve translasyon işleminden olgun proteine bilgi akışını gösterir. Transkripsiyonel faktörler, RNA’lar, kromatin yapı ve epigenetik faktörleri içeren dört organizasyon seviyesinin, memeli genomunda gen ekspresyonunu düzenlediği gittikçe daha fazla anlaşılmaktadır.
Transkripsiyonel düzenleyiciler, komşu genlerin ekspresyonunun pozitif veya negatif kontrolünü sağlayan spesifik DNA motiflerine bağlanır. Genom içerisinde bulunan bilgiler, RNA veya protein ürünlerinin fonksiyonel ünitelerine dönüştürülmelidir. DNA’nın paketlenme ve değiştirilme şekli, DNA bağlayan motiflerden transkripsiyon etkenlerinin geçişini bozarak gen düzenlenmesinin ek şekillerini temsil eder. Postgenomik çağda, zor olan şey, genomun organize, kontrol ve modüle edildiği mimariyi anlamaktır. Nükleozomal organizasyonun transkripsiyon faktörleri, kromatin yapısı ve modifikasyonları, genom içerisindeki gen düzenlenmesinin ana mekanizmalarını oluşturur.
Gen ifadesinde en önemli düzenleyici adım gen transkripsiyonu seviyesinde oluşur. Özgül DNA bağımlı bir RNA polimeraz, genomik DNA içerisindeki bilginin mRNA transkriptlerine kopyalanmasını gerçekleştirir. Transkripsiyon, işlemin hızı ve boyutunu etkileyen nükleotid dizileri içeren transkripsiyon başlangıç yeri olan proksimalde (yani genlerin 5’ucuna doğru) başlar. Bu bölge, genin promotor bölgesi olarak bilinir ve çoğunlukla hem adenin ve timin yönünden zengin olan dizinin bir bölgesini (TATA kutusu) ve hem de başlama yerinin yaklaşık 100 bazı içerisindeki diğer dizi motiflerini içerir. Transkripsiyonu düzenleyen DNA’nın bu bölgeleri etkili regülatör unsurlar olarak bilinir.
Promotor dizinin bu düzenleyici bölgelerinin bazıları, kendileri diğer genler tarafından kodlanan transacting faktörler veya transkripsiyon faktörleri olarak bilinen proteinleri bağlar. Transkripsiyon faktörlerinin bağlandığı bu etkili düzenleyici dizilere çoğunlukla response elementler denir. Transkripsiyon faktörlerinin aileleri belirlenir ve çoğunlukla heliks-sarmal-heliks motifleri, çinko parmak motifleri ve lösin fermuar motifleri içeren protein sekonder yapılarının benzersiz yönleriyle tanımlanır. Transkripsiyon faktörleri, genomun protein kodlayan ürünlerinin tahminen % 3-% 5’ini oluşturur. Gen promotor bölgelerine ek olarak güçlendirici alanları, yukarı veya aşağı (yani genin 3’ucunun ötesinde) ve açık oriyantasyon gereksinimi olmadan başlangıç alanından oldukça uzak bölgelerde oluşması bakımından promotorlardan farklıdır.
Trans-etkili faktörler, bu enhancer bölgelerine bağlanır ve bazı yerlerde işlemdeki belli başlı DNA ilmikIerini oluşturarak promotor bölgelerde transkripsiyon başlatma kompleksinin toplanmasını ve bağlanmasım kolaylaştıracak şekilde DNA’nın tersiyer yapısını veya şeklini değiştirdiğine inanııır. CpG zengin dizilerin metilasyonu gibi seçme promotor veya güçlendirici dizilerinin biyokimyasal modifikasyonu, transkripsiyonu da modüle edebilir; Metilasyon tipik olarak transkripsiyonu bastırabilir. Silencer ve supresör element terimleıi, gen transkripsiyonunu azaltan veya kapatan etkili nükleotid dizileri ifade eder ve bu özgül dizileri tanıyan trans-etkili faktörlerle birlikte yapar.
Transkripsiyon düzenlenmesi, birçok seviyede oluşan karmaşık bir işlemdir. Önemle, birçok genin ekspresyonu, Iıouse-keeping veya temelolarak eksprese edilen genler olarak bilinen yüksek bazal seviyeleri korumak için düzenlenir. Bunlar tipik olarak normal hücre fonksiyonu veya hayatın devamı için gerekli olan protein ürünlerini verir ve bundan dolayı tüm şartlar altında spesifik bir sabit durum konsantrasyonunda tutulmalıdır. Buna karşın, birçok diğer gen eksprese edilmez veya sadece bazal şartlar altında çok az eksprese edilir. Bununla beraber, biraz stresin oluşması veya bazal durumundaki neden farklı olan bir hücre cevabını ortaya çıkaran bir duruma hücrenin maruz kalmasıyla bu genlerin ifadesi başlatılır.
Örneğin, stres proteinleri kodlayan ısı şok protein genleri, birçok hücre ve organizmada çeşitli patofizyolojik uyaranlara (örn., oksidatif stres, ağır metaller ve iltihaplanma) cevaben hızla transkribe edilir. Bu artmış olan ısı şok protein ifadesi, işlevleri moleküler eşlik eden olarak, protein yanlış katlanmasını engellemek, protein yer değişimini artırmak ve protein bozulmasını hızlandırmak için protein sentezi esnasında önemli rol oynayan ısı şok proteinlerinin bazal seviyesini tamamlayıcıdır. Bu uyum cevapları, homeostatik olarak hücre veya organizmaları koruyan fenotipdeki değişikliklere çoğu kez aracılık eder.
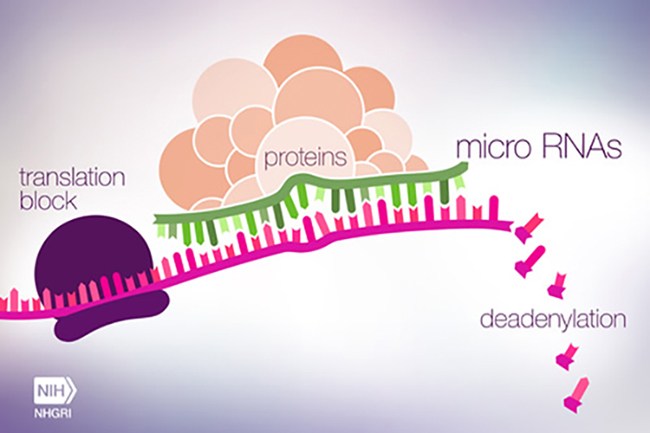
Günümüzde transkripsiyonel düzenlenme hakkında bilinene kıyasla translasyonel düzenlenme hakkında daha az şey bilinmektedir. mikroRNA’lar (miRNA) olarak adlandırılan küçük RNA’ ların (21 -24 mer) son zamanlardaki keşfi ve tanımlanması ökaryotik genom içerisindeki gen ekspresyonunun düzenlenmesine daha fazla karmaşıklık getirmektedir. 5O yıldan daha fazla bir süre önce ilk defa solucanlarda görülen miRNA’lar, translasyonel seviyede protein ekspresyonunun gen susturulmasını sağlayarak hedef mRNA’ların 3’çevrilmemiş bölgesine bağlanan RNA’ların korunmuş kodlanmayan zincirleridir.
Gen şifresini çözen miRNA’lar, doku özgül ifadesini gösterir ve bilinen genlerle ilişkisi olmayan genom bölgelerinde aralara serpiştirilmiştir. miRNA’ların transkripsiyonu, bir mRNA promotorunun kontrolündeki yerlerden birçok adımda ilerlemektedir. RA polimeraz II, 5’ cap ve 3’ poli (A) kuyruğu içeren primer miRNA (primiRNA) denilen öncül miRNA’yı transkribe eder. Çekirdek içerisinde 70 nükleotidden daha büyük primiRNA’ları, Droslla denen çift zincirli RNA spesifik rübonükleaz tarafından tanınan ve sonradan kesilen miRNA parçasını içine alarak içerde saç tokası şeklinde bir ilmik oluştururlar. Gen ekspresyonu, miRNA’nın yıkımı için hedeflenen yeni oluşan RNA moleküleri üzerine etkisiyle susturulur.
Translasyon, tüm mRNA türleri arasında oldukça değişmeyen bir hızda oluştuğu için özgül bir mRNA’nın kararlılığı veya yarı ömrü de gen ifadesinin düzenlenmesinin bir diğer noktasıdır. mRNA’ların çevrilmeyen bölgesi mesajın nükleaz kesim ve yıkıma hassaslığını belirleyen dizi bölgelerini içerir. Kararlılık, özgül ve bazı durumlarda mRNA’lara bağlanan trans-acting etkenlere bağlı dizilimler olarak ortaya çıkabilir. Olgun mRNA’lar, translasyonu düzenleyebilen hem 5’ ve hem de 3’ uçlarındaki çevrilmeyen dizilerin unsurlarını içerir.
Organizmanın erken gelişiminde başlayan miRNA’lar, germ-line (germ hattı) üretimi, hücre farklılaşması, çoğalma ve organ oluşumu için gösterildiği gibi gen ekspresyonunun düzenlenmesi için çok daha karmaşık yolları kolaylaştırmaktadır. Son zamanlarda yapılan çalışmalar beyin gelişimi, kalbin gelişimi, kolon adenokarsinomu ve viral çoğalmada miRNAların ifadesini göstermiştir, gen susturulması için kullanılan bu yeni mekanizma, doğuştan kalp rahatsızlıkları, viral hastalıklar, nörodejenerasyon ve kanser için potansiyel tedavi edici roııere sahiptir.
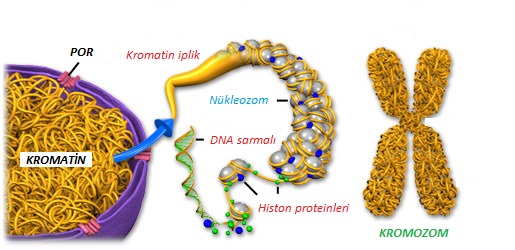
Büyüklük olarak 50-250 megabaz arasında değişiklik gösteren 23 kromozomlu insan genomunun hem büyüklüğü hem de karmaşıklığı, gen düzenlenmesinde DNA bağlayan özelliklerin özgüllüğünü kullanmak amacıyla transkripsiyon faktörleri için büyük zorluklar içermektedir. Gen ekspresyonunun kontrolü de, organizmanın ömrü boyunca mükemmel geçici ve uzamsal özgüııüklü çeşitli hücre türlerinde oluşur.
Ökaryotik hücrelerde genom, kromatin olarak adlandırılan yoğun bir şekilde paketlenmiş çekirdek asitleri DNA ve RNA, protein yapılan içerisinde çok iyi bir şekilde düzenlenir. Kromatinin yapı bloklarına, homozom kütlesinin yarısını kaplayan küçük temel protein ailesi olan histonlar denir. Histonlar, temel özelliklerini esas aminoasitleri olan, arjinin ve lizinden oluşan yüksek içeriklerinden alırlar. Histonların beş önemli türü olan HI, H2A, H2B, H3 ve H4, genomun DNA’slyla kompleks oluşturmak için yavaş yavaş gelişirier.
Her biri dört tip histondan oluşan iki çift, nükleozam oluşturmak için 200 bp’lik DNA ile sarılan histon oktomeri denen bir protein çekirdeğini oluşturur. Nükleozam içerisindeki çekirdek proteinlerinin kovalent değişme için çıkıntılı amino terminal uçları, önemli lizin ve arjinin rezidüleri vardır. Kromozamlar üzerinde yapıların daha fazla sıralanmasıyla DNA’nın paketlenmesi arttırılır. Nükleozomlar daha sonra, çoğalma esnasında DNA zincir ayrışmasına enerji sağlayan negatif süpersarmal yapı ile sonuçlanan sola dönüşlü bir süperheliks ile katmanlı yığınlara sıkıştırılır.
Kromatin içerisindeki DNA’nın yoğunlaştınlması, transkripsiyon faktörleri gibi düzenleyici moleküllerin geçişini engeller. Diğer taraftan, homatin yoğunlaştırılmasının tersine çevrilmesi, tipik olarak çevresel ve diğer gelişimsel sinyallere cevaben doku bağıllı olarak oluşur. Aktif transkripsiyona maruz kalan promotor bölgelerinde kromatin yapının gevşemesi hipersensitif alanlar denilen ve özgülolmayan DNAase tarafından enzimatik kesilmeye hassas olan bölgeler vardır. Promotor alanlardaki transhipsiyon faktörleri, protein-protein etkileşimleri ile birkaç bin baz ötedeki uzak bölgelerde doku özgül proteinleri içeren enhancer unsurlara erişim sağlayabilir ve bunun sonucunda transhipsiyon aktivasyon veya represyonu oluşur.
GEN EKPRESYONUNUN EPİGENETİK KONTROLÜ
Karmaşık düzenleyici şebeke, transhipsiyon faktörlerİ, nükleozomlar, kromatin yapı ve epigenetik işaretler etrafında döner. Epigenetik, DNA dizisinde değişiklik olmaksızın gen ifadesinde kalıtsal değişiklikleri ifade eder. DNA metilasyonu, gen bastırılması, homatin yeniden şekillenmesi ve X kromozam aktivasyonu buna benzer örneklerdir. Bu kalıtım şekli, DNA dizisinde değişiklik olmadan gen fonksiyonunda değişimleri içerir. DNA ~metilasyonunun kimyasal işareti hem hücre özgüldür ve hem de gelişimselolarak düzenlenir. Memeli genomunun %70’inde oluşan spesifik metil transferazlar ile 5’ CpG dinükleotit metilasyonu, gen düzenlenmesinin bir diğer mekanizmasıdır. 5’metil sitozİnin büyük metil grubundan sterik engel, gen ifadesini uyaran veya zayıflatan transhipsiyon etkenlerinin işgalini engeller. Birçok gen, genomda gen aktivitesinin alanlarını yansıtan CpG adalarında bulunur.
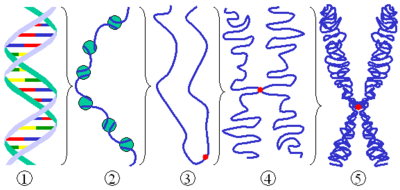
Benzer bir şekilde, fosforilasyon, metilasyon, ubikinasyon ve asetilasyon ile histonun modifikasyonu, kalıtsal olarak geçer ve yeniden yapılandırılır. Diğer epigenetik mekanizmaların DNA genomik modifikasyonlarını içermediği akla gelebilir. Örneğin, östrojen reseptör alfayı kodlayan genin modifikasyonu, meme kanseri hücrelerinde birçok downstream hedeflerin 5mC alanında gen bastırılması ile ilişkili olduğu gösterilir. Güçlü yeni yaklaşımlar, epigenetik işaretlerin geçişinde geri ve ileri besleme ilmiklerini incelemek için geliştirilmektedir. Histon veya epigenesisin dinamik modifikasyonları (örneğin, DNA metilasyonu ve asetilasyonu), kısmen tümörojenik potansiyelde ilerlemeye katkıda bulunduğu fikri hali hazırda mevcut tedavilere dönüştürülmüştür.
Histon asetil transferazlar (HAT) ve histon deasetil transferazlar (HDAC), genoma asetilasyonun ilave edilmesinde ve çıkarılmasında antagonistik roloynarlar. Bundan dolayı, HAT ve HDAC’nin genom çapında analizi, gen düzenlenmesinin karmaşık şekiııerine önemli bakışlar sağlamaya başlamaktadır. Biyokimyasal ve biyolojik aktiviteyle histon deasetilazların birkaç inhibitörü, klinik deneylerde antikanser ajanlar olarak geliştirilip test edilmektedir. Faz 1 klinik deneyleri, bu ilaçların iyi bir şekilde tolere edildiklerini ortaya koymaktadır.
Genelde, deasetilazların inhibisyonu, kromatin montajının biçimini değiştirmekte ve genomun transhipsiyonunu aktif hale getirmektedir. HDAC’ nın hareketlerin in mekanizması apoptozis, hücre döngüsü kontrolü ve hücre farklılaşmasını uzattığı için mevcut klinik deneyler, insan kanserleri için bu yeni ajanların istenen sonucu verme yeteneğini belirlemeye çalışmaktadır.
DNA’daki sabit kalıtsal olabilen bir değişiklik, mutasyon olarak tanımlanır. Bu kesin modern tanım, dizi değişiminin fonksiyonel uygunluğuna bağlı değildir ve primer DNA dizisinde bir değişikliği gösterir. Tarihi bağlamda düşünüldüğünde mutasyonlar ilk defa, bir organizmanın kalıtılabilir fenotipinde belirlenebilen değişikliklerin temelinde tanımlanmıştır. Biyokimyasal fenotipleme, yirminci yüzyılın ortalarında daha kusursuz hale geldiğinde araştırmacılar, birçok proteinin bir popülasyonda birden fazla formda var olduğunu kanıtlamışlardır ve bu formlar, o protein için (örn., alelik varyasyon) kodlama yapan gendeki varyasyonların sonucu olarak görülmüştür.
DNA dizileme metotlarındaki ilerlemeler sayesinde mutasyon kavramı, fenotipdeki değişiklikleri belirleyerek ayrılabilenden, DNA’nın yapısındaki değişiklikler seviyesinde kesin olarak tanımlanabilene yavaş yavaş dönüşmüştür. Çoğu mutasyon, ebeveynlerden çocuklara bozulmadan geçmesine rağmen, bazıları genetik bakımdan öldürücüdür ve bundan dolayı geçirilmez. Buna ilaveten, oldukça değişken sayıda tekrar (birbiri ardına tekrarlar) eden dizileri içeren genomun bölgelerinin keşfi, bazı mutasyonların diğerlerinden daha az kararlı olduğunu ortaya koymaktadır.
Mutasyonların moleküler doğası oldukça çeşitlidir. Bir mutasyon, hepsi nokta ımltasyonlar olarak oluştuğu söylenen bir tek bazın kaybını (delesyonunu), araya girmesini (insersiyon) veya yerine geçmeyi (substitusyon) içerebilir. Yerine geçme daha sonra, mutasyona uğramış üçıüyle kodlanan amino asitler değişmezse sessiz (sitent), mutasyona uğramış üçlüyle kodlanan amino asitler değişirse yanlış anlamlı (missens) ve mutasyon, translasyonun erken sonlanmasına (stop kodon) sebep olduğunda ise anlamsız (nonsens) olarak sınıflandırılabilir. Ara sıra nokta mutasyonlar, birbiri ardına gelen kesip-çıkarma alanları (splice-site) oluşturarak veya bir kesip-çıkarma alanını çıkartarak öncü mRNA’nın işleyişini değiştirebilir. Bir ekzonda tek veya çift delesyon veya insersiyon olduğunda, çoğunlukla okuma çerçevesi (in-frame) içerisinde oluşan dur kodonuyla translasyonun erken sonlanmasına sebep olan bir çerçeve kayması (frameshift) mutasyonu oluşur.

Mutasyonlar spektrumunun diğer ucu, bütün genin veya bir dizi bitişik genlerin büyük çaplı delesyonunu içerir; delesyon, duplikasyon ve bir kromozomun bir parçasının başka bir kromozoma gitmesi (transloke olması) veya bir tam kromozomun duplikasyonu veya delesyonudur. Böyle kromozom mutasyonları, birçok kanserin gelişiminde önemli roloynamaktadır. Her birey, her bir ebeveynden birer tane olmak üzere her bir gen lokusu için iki alel taşır. Herhangi bir gen onkusu için benzer aleller homozigositeyi, benzer olmayan
aleller heterozigositeyi tanımlar. Bu alellerin kalıtılabilirliği, tipik Mendel kurallarına uyar. Mutasyonların ve alelik çeşitliliğin moleküler temelinin daha iyi anlaşılması ile popülasyonlardaki dağılımı, spesifik DNA dizilerini izleyerek analiz edilebilir.
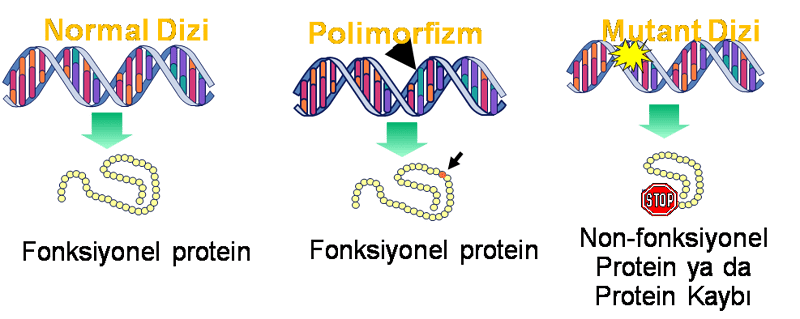
Bir popülasyon bağlamında çalışılan DNA dizilerindeki farklılıklar, genetik polimorfizim olarak tanımlanır ve bu polimorfizimler, verilen bir tür ve türler arasında gözlenen farklılığın temelinde
yatmaktadır. Bir popülasyonda benign polimorfizimlerin yüksek oranda görünmesine rağmen buna kıyasla zararlı mutasyonların daha nadir olmasının sebebi doğal seleksiyonun popülasyondan en zararlı mutasyonları elimine etmesi (Ietalite) ve genomik dizilimdeki polimorfik değişikliklerin çeşitliliğidir. Genomun bazı kısımları, dikkat çekecek bir şekilde durağan ve polimorfik varyasyonsuzdur, halbuki dizi değişikliğinin işlevsel benignitesinin bir sonucu olarak içerisindeki çeşitliliğin persistansı olan diğer kısımları oldukça polimorfiktir. Başka bir deyimle, bireyler arasında DNA dizisindeki polimorfik farklılıklar, fenotipde etki oluşturmayanlar, fenotipde benign değişikliğe sebep olanlar (örn., normal genetik varyasyon) ve fenotipde kötü sonuçlar oluşturanlar (örn., mutasyonlar) diye ayrılırlar. Son grup kendi içinde monogenik hastalıklar gibi (örn., orak hücreli anemi) tek başına anormal bir fenotip oluşturabilen polimorfik mutasyonlar ve tek başına bunu yapamayan fakat diğer mutasyonlarla birleştiğinde anormal fenotip oluşturabilen (kompleks hastalıklar [örn., esansiyel hipertansiyon]) polimorfik mutasyonlar diye ayrılabilir.
Polimorflzimler, kodlayan bölgelere kıyasla genomu kodlamayan bölgelerde daha yaygındır ve bunların yaygın türlerinden biri, kısa DNA dizilerinin bir çok kez birbiri ardına tekrarını içerir. Eğer bu tandem tekrarları uzunsa, o zaman bunlara değişken sayıda tandem tekrarları (VNTR) denir; eğer bu tekrarlar kısa ise, kısa tandem tekrarlan (STR) denir. Mitoz esnasında, tandem tekrarlarının sayısı değişebilir ve bu çeşit replikasyon hataları bir toplumda alternatif uzunlukta tandem tekrarları yapacak kadar yüksektir. Bununla beraber, tandem sıklığının uzunluğundaki değişim hızı, ailelerde istiharIı bir genotip özellik olarak polimorfizimin büyüklüğünü faydalı kılacak kadar düşüktür. Bu özellikleri göz önüne alarak polimorfik tandem tekrarları, spesifik genomik onkuslar ailesel kalıtımın belirlenmesinde oldukça faydalıdır.
Polimorfik tandem tekrarları, cross-over ve rekombinasyon olayları esnasında diğer genlere bağlanmasının analiziyle bunların özgül ilgili genler için genetik belirleyiciler olarak hizmet vermesini sağlar ve tüm genomik dizi boyunca yaygındır. İnsan genomundaki birçok genetik polimorfizimlerin analizleri, genomik DNA’da dizi seviyesinde (genotyping) bireyler arasında belirgin bir varyasyonun bulunduğunu göstermektedir. En yaygın varyantı olan tek-nükleotid polimorfizim (S P), DNA dizisinin verilen herhangi bir yerinde kromozomlar arasında tek bazla farklılık gösterir.
Dünyayı temsil eden popülasyonun genotiplenmesiyle (300 bazda bir olmak üzere) 50 milyon varyantın, geri kalan % 10’u oluşturan nadir varyantla birlikte toplumdaki yaygın SNP varyantının % 90’ınl oluşturduğu tahmin edilmektedir. Bir türün her bir jenerasyonunda bir gendeki polimorfik değişikliklerin sıklığı 10-4 ile 10-7 arasıdır. Bundan dolayı, insan genomundaki genlerin sayısını göz önünde bulundurduğumuzda insan genomunun baz sekansının % 0.5 ve % 1.0 arası polimorfiktir. Bu bağlamda, yeni varyant, mutasyon olayı esnasında var olan kromozom geçmişinde etraftaki aleilere kadar izlenebilir. Bir haplotip, bir kromozom veya bir kromozom parçası üzerindeki bir spesifik alel dizisi veya kombinasyonudur.
Anne-baba kromozomları cross-over’a girince, ek mutasyonlar içeren yeni mozaik haplotipler, böyle rekombinasyonlardan oluşur. Haplotipler içerisindeki SNP alelleri, linkage disequilibrium (bağlantı eşitsizliği) (LD) denen popülasyon içerisinde diğer alellerle birlikte beraberce kalıtılabilir. İki SNP arasındaki bu ilişki, artan mesafe ile azalır ve LO’ nin örneklerinin S P’nin yakınlığıyla belirlenmesini sağlar. Bunun tersine, birkaç iyi seçilmiş SNP, çoğu kez bölgedeki diğer ortak varyantıarın yerini tahmin etmek için yeterlidir.
Mutasyonla ilişkili haplotiplerin genel popülasyonda binlerce jenerasyondan sonra yeniden birleşme yoluyla yaygınlaşması beklenmektedir. Bunun tersine, LD ile genetik haritalama, tüm insan popülasyonunu kurulmuş bir pedigrisi olmayan büyük bir aile ağacı olarak kullanarak geleneksel Mendel genetiğinden ayrılmaktadır. Muhtemel LO milyon varyantın Uluslararası Hapmap Projesi ve Perlegen özel girişimi farklı toplum örneklerini temsil eden 341’ den fazla insandan elde edilen genel insan SNP haritasını içeren 8 milyondan fazla varyantı depolamaktadır. Birbiriyle ilişkisiz bireylerin genomunda dağılmış olan S P’ ler, genotip ve ılımlı fenotipler arasında çizilebilecek istatistiksel ilişkiler için yeterince sağlamlaştırılması bir hücre veya organizma içerisinde fonksiyonel eksikliğe sebep olan belirli bir tip alellik polimorfizim olarak tanımlanabilir. ’
Hastalıkla birlikte ayrılan iyi tanımlanmış fenotipli 1 tek genli hastalıklar arasındaki nedensel ilişki, etkilenmemiş kontrol grubuyla kıyaslandığında sadece az sayıda etkilenmiş bireylere ihtiyaç duymaktadır. Bunun aksine, karmaşık hastalıklar (örneğin, diyabet, hipertansiyon ve kanser), çevresel etkenler ve gizli etkili genlerin kombinasyonel etkilerini gerektirecektir. Hastalar ve genel popülasyon arasındaki varyasyonları genetik frekansta sadece araştırmakla, hastalığın sebebi anlaşılabilir. Postgenomik çağda gen haritalama, binlerden 100.000 baz çifte uzanan LD ve yüksek yoğunluklu gen haritalarının kullanımı ile istatistiksel ilişkiyi gerektirmektedir.
Kapsamlı ilişki çalışmalarının klinik uygulamada rutin olmasını sağlamak için masrafı az olan genotip testlerin ve bütün yaygın polimorfizmli daha yoğun haritaların, hastalığın tüm muhtemel belirtileriyle bağlantılı olmaiarı gerekmektedir. Hapmap ve Perlegen gruplarının uzun süre çalışması gelecekteki klinik olaylara diyet, egzersiz, çevresel faktörler ve aile hikayesinin etkilerini belirleyecektir. Güvenilir yeterli örnek sayılarına ve bilgi setlerine benzer yaklaşımlar olmadan, genetik popülasyon teorisi vaadi insan dizi varyasyonlarının karmaşık hastalıklar ile bağlantısının doğal sınırlamalarının üstesinden gelemeyecektir.

Genom haritalama yöntemi, genom boyunca özgül onkusların izafi sırasının ve aralarındaki mesafelerin belirlenmesini içerir. Haritalar genetik ve fiziksel olmak üzere iki çeşit olabilir. Genetik haritalar, diğer bilinen lokuslarla ilgili lokus]arın rekombinasyon sıklığına dayalı istatistiksel bir analizle özgül genetik lokusların genomik yerlerini tanımlar. Fiziksel haritalar, ilgili lokusların bir veya daha fazla tanımlanmış belirleyici (markır) ile ilişkili olarak, bulunduğu genom boyunca mesafenin doğrudan ölçülmesiyle özgül genetik lokuslarının genomik yerini tanımlamaktadır. Genlerin bir kromozom üzerindeki kesin yeri, mayoz esnasında genetik rekombinasyon oluştuğunda bir kromozoni parçasının tamamlayıcı kromozomunun ilgili parçası ile değişme veya cross-over yapma ihtimalini tanımlamada önemlidir.
Mayotik rekombinasyon esnasında bir ebeveynden alınan genetik lokuslar veya aleller yeni alel kombinasyonu oluşturmak üzere diğer ebeveynlerden alınanlarla değiş-tokuş edilir ve mayozda alellerin tekrar birleşeceği ihtimali, kromozomal dizide birbirinden lineer uzakIıklarının bir fonksiyonu olarak değişiklik gösterir.
Bu rekombinasyon olasılığı veya uzaklığı genelde centiMorgan (cM) olarak hesaplanır. CM, mayoz esnasında iki alelin cross-over’a girme ihtimalinin % i olduğu kromozomal mesafe olarak tanımlanır. Cross-over olayları gelişim esnasında ebeveyn dizilerinin karışmasında hizmet eder ve bu yüzden çocuklar arasında genetik farklılık oluşturur. Beraber kalıtılmaya eğilim gösteren spesifik alellerin analizi, insan genomunda rekombinasyon mesafesinin yaklaşık 3000cM olduğunu göstermektedir. Özgül çok genli hastalık fenotipinden sorumlu gen veya genleri belirlemek, çevreyle etkileşimlerle içinden çıkılamayacak kadar bağlantılı olan insan genomunun topografik anatomisini anlamayı gerektirmektedir.
İlk defa 1985 yılında önerilen İnsan Genom Projesi, tüm genlerin belirlenip karakterize edilmesinin fiziksel ve transkript haritalarının yanında ayrıntılı genetik haritalarının yapılması dahil insan genomunun tam nükleotid dizisini belirlemek için uluslararası bir çabayı temsil etmiştir. Bu büyük ölçekli biyolojik akın, hayatı boyunca çift heliksden üç milyar insan genom bazının dizilimine giden yola şahit olan, insan evrimini anlayan ve insan sağlığı için faydalarını kullanan Nobel ödüllü James Watson tarafından savunulmuştur. İnsan Genom Projesinin ilk başarıları arasında her biri 3000 marker ve 52.000 dizilenmiş hedef bö]gelerin (Sequenced Tagged Sites) tanımlanmasını içeren cM çözünürlüklü haritaların geliştirilmesi vardı.
Bir genom geniş ölçeğinde (genome-wide scale) fonksiyonel bir analiz için yüksek miktarlı oligonükleotid sentezi, normalleştirilmiş ve eksiıtilmiş (subtracted) tamamlayıcı (komplementer) DNA (cD A) kütüphaneleri ve DNA mikrodizileri (micro-array) gibi önemli teknolojik ilerlemeler geliştirilmişti. 1998’de Celera özel girişimi, insan genomunun dizisini belir]emek için shutgun (av tüfeği) sekansı diye adlandırılan devrimci bir yaklaşımı kullanarak İnsan Genom Projesi gibi benzer bir hedefi önerdi. Shotgun dizileme metodu, rastgele büyük çaplı dizileme ve sayısal ve matematik modellemeyi kullanan dizilenmiş (sequenced) segmenlerin birbirini takip eden sıralaması için dizayn edilmiştir.
Nihayetinde, Celera özel girişim ile ortak çalışmayla İnsanGenom Projesi, 2001 yılında tüm insan genomunun rötüş edilmiş bir haritasını oluşturmuştur. Normal biyolojik varyasyonlar veya dizi polimorfizimlerinin bir sonucu olarak ortaya çıkan genomik dizideki farklılıklardan dolayı oluşan sınırlı parça uzunluk polimorfizimleri (RFLP) bireyler arasında farklılıklar gösterir ve Mendel prensiplerine göre kalıtılır. Bu polimorfizimler, genomdaki özgül lokuslar için genetik belirleyici olarak görev yaparlar. Genom içerisindeki genetik lokusların loka]izasyonu için RFLP’nin en faydalı türlerinden birisi dizi tandem tekrarları tarafından oluşturulandır. Tandem tekrarları, STR’ler durumunda replikasyon esnasında DNA polimerazın kayması veya duraksamasından dolayı ortaya çıkar; daha uzun varyasyonlar, eşit olmayan cross-over olaylarından dolayı oluşur. STR’ler, genomun her tarafına dağılmıştır ve çok polimorfiktir.
Bu belirleyicilerin her bir ebeveynden alınan her bir lokusda iki farklı alelinin olması önemlidir. Bundan dolayı, iki kromozomun orijinleri bu analizle ayırt edilebilir. Genomik belirleyiciler olarak genomun her tarafında oluşan yüksek derecede polimorfik tandem tekrarlarının kullanımı, seçilmiş belirleyicilerle bir ilişki veya bağlantı kurma yoluyla spesifik gen lokuslarının haritasını Çıkartmak için bir temel oluşturmaktadır. Bağlantı analizi, basit bir prensibe dayanır: Mayoz esnasında bir crossoverın oluşma ihtimali, ilgili lokusun verilen bir belirleyiciye yakınlığı ile azaltır. Genetik bağlantının büyüklüğü, bir tanesi hastalık oluşturan mutasyon içerebilen herhangi bir lokus grubu için araştırılabilir.
Özgül bir insan hastalığına sebep olduğu bilinen özgül bir gen dizisinin yapısını ortaya çıkartmak, ilgili gendeki mutasyonları tespit etmeyi gerektirir. Eğer hastalık fenotipinden sorumlu olduğuna inanılan gen bilinirse, o zaman onun dizisi de klasik klonlama ve dizi bulma stratejileri ile tespit edilebilir ve mutasyon belirlenebilir. Günümüzde mutasyonları belirlemek için çok çeşitli yöntemler vardır. Büyük miktarda DNA eklenmesini (insersiyon) veya çıkarılmasını (delesyon) gerektiren mutasyonlar, içerisinde izole edilmiş DNA’nın, komplementer dizisinin radyoaktif olarak işaretlenen bir parçasına bağlandığı (anneal) Soothern blot yöntemiyle bulunabilir. Agaroz jel elektroforeziyle gözlenebilen daha küçük DNA parçalarını oluşturan ve DNA dizisini spesifik yerlerden kesen özel restriksiyon enzimleriyle (endonükleazlar), DNA muamele edilir. Yabanıl tür diziye kıyasla, jel üzerindeki hareketlilikteki değişiklikler, elde edilen fragmanın moleküler büyüklüğündeki değişikliğe göre oluşur. Buna alternatif olarak, polimeraz zincir reaksiyonu (PCR), mutasyonları bulmak için kullanılabilir
Bu yaklaşımda, ilgili dizideki DNA’ya eşlenik ve çift zincirli ONA’nın her bir zincirinin tamamlayıcısı olan ve 20-40 baz uzunluğundaki küçük oligonükleotidler sentezlenir ve ilgili DNA dizisinin çoğaltılması için primer olarak görev yapar. Bu primerler DNA solüsyonuna eklenirler. Bu solüsyonun sıcaklığı her bir DNA zincirini açmak için artırılır ve daha sonra primerlerin kendi tamamlayıcı kalıp hedef bölgelerine bağlanmalarını sağlamak için düşürülür. ısıya dayanıklı bir DNA polimeraz, primer bağlanma (anneal) bölgesinden 5’ -3’ yönünde yeni DNA’yl sentezlemesi için reaksiyona dahil edilir. Sıcaklık dubleks yapıları çözmek için artırılır ve bir diğer siklusun oluşmasını sağlamak için sıcaklık düşürülür. Birkaç sıcaklık siklusu ilgili dizi konsantrasyonunu sürekli çoğaltmak için kullanılır ki bu PCR ürünü olarak agaroz jel elektroforezinde floresan bir boya yardımıyla gözlenebilir.
PCR ürünü izole edilebilir ve düşünülen mutasyonu bulmak için dizi analizi yapılabilir. Eğer gen büyükse ve mutasyonun yeri bilinmiyorsa (özellikle de nokta mutasyon), o zaman ekzonik dizide muhtemel mutasyona uğrayan yeri bulmak için diğer metotlar kullanılabilir. Yaygın olarak kullanılan bir yaklaşım, denatüre etmeyen bir agaroz jeldeki hareketlilikte değişime sebep olan (örn., tek zincirli konformasyonel polimorfizim) ebeveyn DNA ve PCR ürünleri arasında kısa kompleksIerin yapısal konformasyonunu değiştiren mutasyonlar için gen dizisini taramayı gerektirmektedir. Tek bir nükleotid değişimi veya delesyonu, yabanıl tipi kompleksIere kıyasla kompleksi n konformasyonunu değiştirebilir ve bu hareketlilikte bir değişime sebep olabilir. Daha sonra, genin bu nispeten küçük bölgesinin dizi analizinin yapılması mutasyonun tam olarak bulunmasını kolaylaştırır. Hastalık fenotipine sebep olduğuna inanılan gen bilinmediğinde, genom üzerindeki muhtemel pozisyonu tespit edilmediğinde veya sadece sınırlı haritalama bilgisi mevcut olduğunda, mutasyona uğramış geni belirlemekiçin aday gen yaklaşımı kullanılabilir. Bu stratejide potansiyel aday genler, hayvan modellerine benzeme bazında veya sınırlı bilginin bulunduğu genom bölgesinde haritalanan genlerin analiziyle belirlenir.
Aday gen daha sonra potansiyel mutasyonlar için analiz edilir. Kullanılan yaklaşıma dikkat edilmeksizin aday genlerde belirlenen mutasyonlar, gen ürünündeki fonksiyonel değişikliklerle her zaman bağlantılı olmalıdır çünkü bazı mutasyonlar fenotipik sonuçları olmadan polimorfizimi temsil ettikleri için fonksiyonel olarak sessizdir. Gen ürünündeki fonksiyonel değişiklikler, ilgili genin cDNA’slnı taşıyan vektör ile hücreyi kısa süreli olarak transfekte etme ve ilgili mutasyonu birleştirme yoluyla mutant proteini ürettirerek protein fonksiyonunu değerlendirmek için hücre kültür sisteminin kullanımıyla değerlendirilebilir. Alternatif olarak, süper ovülasyonla hamile bırakılan bir dişiden alınan oositlerin erkek pronükleusu ile birleştirildiği eşsiz hayvan modelleri geliştirilebilir. Bu birleşme, mutant geni fazlasıyla üreten bir hayvan modeli oluşturur. Yani bu durum, transgenik bir hayvan veya verilen bir genin normal sayısından daha fazlasına sahip bir hayvan veya ilgili genin bozulduğu ve gen ürününün sentez edilmediği bir hayvan örneğin
veya verilen bir genin normal sayısının yarısına sahip (heterozigotlu) bir hayvan veya hiçbiri olmayan bir hayvan oluşur.
Moleküler tekniklerin gücü, kalıtsal bir hastalığın moleküler temelini tanımlamadaki kullanımının ötesine uzanmaktadır. Nadir nükleik asit dizilerini çoğaltmak için PCR’ın yüksek hassaslığını kullanarak eşsiz dizilere sahip bazı bulaşıcı hastalıkları hızlı bir şekilde teşhis etmek mümkündür. Özellikle zor veya yavaş çoğalan organizmaların sebep olduğu enfeksiyonlar, Mycobacterium tuberculosis vakasına benzer şekilde artık hızla teşhis edilebilmektedir. Mikroorganizmalarda belirli anti biyotiklere direnç gösteren genlerin bulunması da PCR teknikleriyle doğrulanabilir. Escherichia coli, M. tuberculosis ve Treponema pallidum gibi organizmaların tüm genomunun dizilenmesi şimdi, enfeksiyonların epidemiyolojik yapılarını izlemek, edinilen mutasyonların gidişatını takip etmek, antibiyotik tedavilerini yapmak ve geleneksel antibiyotik tedavilerinin etkisiz olduğu veya az etkili olduğu enfeksiyon ajanları için eşsiz gen bazlı tedaviler (vide infra) geliştirmek için emsalsiz fırsatlar sunmaktadır.
Moleküler metotların insan genomuna uygulanması açıkca alanı tamamen değiştirmiştir. Bağlantı analizi ile PCR’ i birleştiren yaklaşımların kullanılmasıyla basit nokta mutasyonlar tam olarak lokalize edilebilmekte ve karakterize edilmcktedir. Hastalıkların altında yatan geneıik değişiklikler spektrumunun diğer ucundaki kromozomal karşılıklı yer değiştirmeler (translokasyonlar). delesyonlar vc duplikasyonlar, geleneksel sitogenetik metotlarla belirlenebilir. Büyük delesyonlar, birçok kilobaz çiftler ve birçok genler içerisinde klonlanmış bir DNA parçasının bir tloresan etiketi ile etiketlendiği ve kromozomal DNA’yla melezleştirildiği (hibridize edildiği) bir teknik olan tloresan in situ melezleştirme (hibridizasyon) (FISH) ile görüntülenebilir. Genomdan ilgili bölgenin delesyonuyla kromozomal DNA, karşılık gelen kromozom yerinde ışık verme (tloresans) gücünden düşer. Moleküler tıptaki ilerlemeler, karsinogenez mekanizmasının anlaşılmasının yanında neoplastik hastalıkların teşhis ve tedavilerine olan yaklaşımı da tamamen değiştirmiştir.
Günümüzdeki görüşlere göre bir neoplazma, kontrol altındaki dinlenme durumundan kontrol altında olmayan büyüme evresine geçen tek bir hücrenin klonal proliferasyonundan kaynaklanmaktadır. Dış faktörler (örn., radyasyona maruz kalma) veya kalıtsal belirleyicilerin sonucunda DNA hasarı ana tümör hücresinde toplanır. Karsinogenezin ilk evrelerinde belirli genomik değişiklikler, ek hasar olasılığını artıran iç genetik istikrarsızlığı bildirebilir. Karsinogenez esnasında aktive olan bir sınıf gen, normalde memeli genomunda inaktif (proto-onkogen) durumda bulunan fakat aktif olduğunda da özgül hücreler arası sinyal yolunun aktif hale gelmesiyle düzensiz hücre çoğalmasını geliştiren primordiyal genler olan onkogenlerdir.
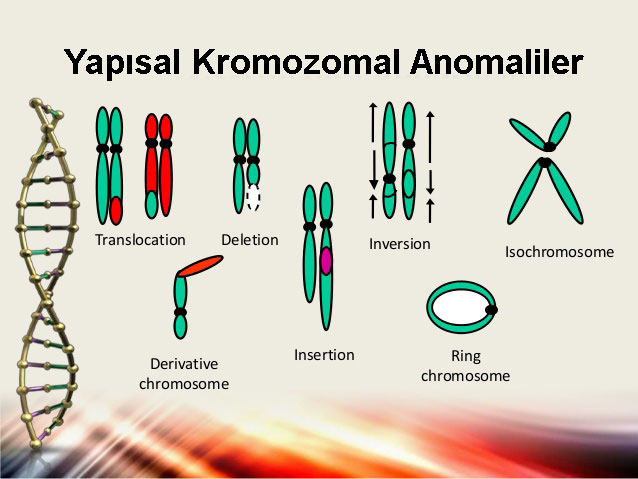
Büyük kromozom anormalliklerinin onkogenik belirleyicilerin (markırların) oluşturduğu eşsiz DNA dizileri (örn., onkogenezisi ilerleten translokasyonlar veya delesyonlar) ve özgül tümör belirleyicilerinjn ayırt edilmesine dayalı moleküler metotlar habis tümörlerin teşhisinde yaygın bir şekilde kullanılmaktadır. Bu metotlar, biyopsi örneklerindeki özgül tümör belirleyicileri ve onkogenlerin varlığını belirlemek, kemoterapi tamamlandıktan sonra dolaşan habis tümör hücrelerinin varlığını gözlemek ve özgül kemoterapötik ajanlara gen rezistansının gelişmesini belirlemek için kullanılabilir. Buna ek olarak, geleneksel bağlantı analizi ve aday gen yaklaşımlarının kullanılmasıyla gelecekteki çalışmalar habis tümör dönüşümüne kalıtsal yatkınlığı olan bireylerin belirlenmesini sağlayacaktır.
Gen çip teknolojileri ve gen ifadesi dizilerinin (array) gelişi, moleküler tanıyı tamamen değiştirmiştir ve karmaşık hastalıkların patobiyolojik yapılarını aydınlatmaya başlamıştır. Bu metotlar, bir hücre veya dokudan izole edilen total mRNA’dan üretilen cDNA’yl radyoaktif veya tloresan işaretle etiketlerneyi ve bu heterojen popülasyonun bilinen dizinin birçok farklı polinükleotidlerinin bağlandığı katı bir alt tabakaya bağlanmasını gerektirir. Dizi (array) üzerinde spesifik yerlere bağlı etiketlenmiş cDNA dizilerinden sinyaller izlenir ve belirli dizilerin nispi çokluğu referans numuneden alınanlarla kıyaslanır.
Bu yaklaşımı kullanarak mikro dizi paternleri, ifadesi spesifik bir hastalık durumunda artan veya azalan (örn., hastalık modife eden genlerin belirlenmesi) genleri belirlemenin yanında belirli bir hastalığı teşhis etmek için (örn., habis tümör türü ve onun prognozu ve tedaviye duyarlılığı) moleküler parmak izi olarak kullanılabilir. Elbette, bulaşıcı hastalıklar ve onkolojide bu uygulamalara ek olarak moleküler tıp tekniklerinin birçok diğer uygulamaları vardır. Moleküler metotlar, popülasyondaki bireylerin farmakolojik yanıtlarını (jarmakogenomiks) değiştirebilen metabolizmadaki genetik farklılıkları düzenlemek, babalık veya kriminal suçluiuğu tanımlamak ve tam bir genetik bazda epidemiyolojik analizlere yaklaşmak için kullanılabilir.
GENLER VE İNSAN HASTALlKLARI
İnsanlarda görülen genetik hastalıklar kabaca üç kategoriye ayrılabilirler;
- Tek bir gendeki mutasyona bağlı olanlar (örn., monogenik hastalıklar, Mendeliyan kalıtılan hastalıklar)
- Birden çok gende oluşan mutasyon nedeniyle ortaya çıkanlar (örn., çok genli hastalıklar, kompleks hastalıklar)
- Kromozomal hastalıklar
Her üç grup hastalıkta da; çevresel faktörler hastalığa yol açan genin fenotipik bulgularına katkıda bulunabilir. Orak hücreli anemi, ailevi hiperkolesterolemi ve kistik fibrozis klasik monogenik bozukluklardır. Önemli bir nokta, bu genetik hastalıklar tek özgül bir mutasyonla oretaya çıkabileceği gibi (orak hücreli anemi), birçok hastalığa yol açan mutasyondan herhangi biri sonucunda da (familyal hiperkolesterolemi, CF) ortaya çıkabilir (Pauling Paradigması). İlginç olarak bu hastalıklardan bazıları kişiyi koruyucu özellik gösterir. Örneğin, orak hücreli anemisi olan hastalar falsiparum sıtmasına, Kistik fibrozisli hastalar ise koleraya karşı dirençlidirler. Çok genli veya kompleks kalıtım kalıplı hastalıklara örnekler; DM, aterosklerotik kardiyovasküler hastalık ve esansiyel hipertansiyondur. Kromozomal hastalıklara en yaygın örnek üç tane 21. kromozomun olduğu trizomi 21’dir. Monogenik bozuklukların sıklığı yaklaşık %1’dir.
Bunlardan hayatının herhangi bir sonraki kısmında genetik temelli çok genli hastalık geliştirme sıklığı %60’dır ve yaklaşık %0.5 monogenik bozukluk kromozomal anomalileri içerir. Kromozomal anomaliler kendiliğinden olan düşüklerin ve malformasyonların sık bir sebebidir. En başlarda genetikçilerin düşündüklerinin tersine oldukça az sayıda fenotip tek bir genetik lokusta tanımlanmıştır. Bu nedenle monogenik bozukluklar yaygın değildir, bununla beraber kalıtımın temel prensiplerini anlamak için oldukça kullanışlıdırlar. Monogenik bozukluklar üç tiptir: otozomal dominant, otozomal resesif ve X’ e bağlı.
Dominantlık ve resesiflik terimleri genetik özelliğin kalıtılabilme doğasını yansıtır ve hedef lokusdaki etkilenmiş alel sayısı ile ilişkilidir. Eğer tek bir aleldeki mutasyon fenotipi belirliyor ise bu mutasyon dominant olarak isimlendirilir ve heterozigot durumu bireyde klinik fenotipe yol açar. Tersine, eğer fenotipi belirlemek için her iki alelde de mutasyona ihtiyaç varsa bu mutasyona resesif denilir ve sadece homozigot durumunda klinik fenotipe yol açar. Dominant veya resesif mutasyonlar gen ürününde fonksiyon kaybı veya kazanımına yol açabilirler. Eğer mutasyon X kromozomu üzerinde ise, X’ e bağlı olarak isimlendirilir (erkeklerde dominant özellik gösterir) diğer haller otozomaldir. Potansiyel genetik hastalığın kalıtım kalıbının bu üç gruptan birine dahil edilebilmesinin önemi, eğer bu üçünden birisi ise, hastalık tek bir genetik anormalliğin ürettiği anormal bir proteinin sonucu ortaya çıkmıştır.
Klasik olarak tespit edilebilen genetik hastalıklar, kodlayan (ekzonik) dizileri etkileyen mutasyon nedeniyle ortaya çıkar. Bununla beraber intronik veya diğer çevrilmeyen bölgelerdeki genomda olan mutasyonlar, özgül genlerin fonksiyon veya ifadelerini etkileyebilir. Bu tip mutasyonlarla ortaya Çıkan hastalıklara örnek olarak miyotonik distrofi ve Friedreich’s ataksisi verilebilir. Dominant monogenik bozukluğa sahip olan bireyler, tipik olarak bir tane etkilenmiş anne veya babaya sahiptirler ve kız/erkek çocuklarına bu hastalığı geçirme riski %50’dir. Ek olarak, erkek ve kızlar eşit olarak etkilenirler ve eşit olarak hastalığı kız/erkek çocuklarına aktarırlar. Bu kalıtım, etkilenmemiş bir anne veya baba yokluğunda aktarılamaz. Tersine, resesif monogenik hastalıklara sahip bireyler tipik klinik olarak normal anne-babaya sahiptirler.
Taşıyıcı (her biri heterozigot olarak mutasyon taşıyan birey) anne-baba, %25 oranında hasta çocuğa sahip olabilirken, %50 oranında heterozigot normal çocuklara sahip olabilir. Yaygın monogenik bozuklukların bariz kalıtılabilirliğine rağmen (örn., orak hücreli anemi), bu hastalıkların beklenen klinik bulguları çeşitli olabilir. Klinik ifadedeki bu çeşitlilik, bir mutasyonu taşıyan bireyde gözlenen fenotipik etkinin derecesi olarak tanımlanır. Penetrans, bir mutasyonun yol açtığı değişik klinik !f"adelibireylerin daha küçük bir alt grubuna içine alır ve mutant genotipe sahip bireylerden, hastalığın tipik klinik fenotipik özelliklerini
ortaya çıkaranların oranıdır.
Belirli bir genetik bozukluğun klinik ifadesindeki çeşitliliğin veya tam olmayan penetransın üç temel belirleyicisi vardır; bunlar 1) çevresel faktörler, 2) diğer genetik lokusların etkileri, 3) rastgele şansdır. çevresel faktörler, transkripsiyon faktörleri üzerindeki etkileri [örneğin, hücrenin yükseltgenme- indirgenme (redoks) durumuna duyarlı transkripsiyon faktörleri-nükleer faktör Kbeta], veya gen promotorlarındaki ciselementleri (örn., CpG bakımından zengin bölgelerin folat bağımlı metilasyonu) veya translasyon sonrası proteinleri modifiye etme (örneğin,lizin oksidasyonu) gibi yollar dahilolmak üzere birkaç yolla gen ifadesini değiştirerek hastalık fenotipini değiştirebilirler.
Diğer genlerin, hastalığa sebep olan mutasyonların etkilerini değiştirmesi primer hastalık fenotipindeki genetik çeşitliliği yansıtır. Bu genlerin etkisine bir çok örnek mevcuttur. Hastalık modifiye eden genler olarak isimlendirilen bu genler aynı primer hastalığa yol açan mutasyona sahip bireyler arasındaki fenotipik varyasyonlara yol açarlar (gen-gen etkileşimi) ve hastalık modifiye eden genlerin etkileri, çevresel belirleyicilerle fenotipi daha da fazla değiştirebilir (gen-çevre etkileşimleri). Böyle etkileşimler özellikle çok genli (poligenik) hastalıklar için önemlidir; gen-gen ve gen-çevre etkileşimleri hastalığın fenotipik ifadesini değiştirebilir. Örneğin, orak hücreli anemili hastalar arasında bazıları ağrılı krizlere girerken, bazılarında akut torasik sendrom gelişmekte, bazılarında ise hemolitik bozukJuklar ortaya çıkmaktadır.
Mitokondrial DNA’yl etkileyen genetik bozukluklar bulunmuştur. Mitokondrial DNA sadece anne tarafından kalıtılması açısından eşsizdir. Ek olarak mit DNA’daki mutasyonlar aynı hücre içinde veya aynı bireydeki mitokondriler arasında değişkenlik gösterebilir (heteroplazmi). Mitokondrial genom temelli genetik hastalıklara örnekler; Kearns-Sayre sendromu, ve Leberin herediter optik nöropatisidir. Bilinen mİtokondrial genetik hastalıkların listesi gün geçtikçe artmaktadır ve çok sayıdaki yaygın çok genli bozukluklara mİtokondrial katkı da olabilir.
MOLEKÜLER TIP
Günümüzdeki moleküler stratejilerin temel amacı, normal gen fonksiyonunu genetik mutasyonlu bireylere yeniden sağlamaktır. Bunu gerçekleştirecek metotlar henüz primitiftir ve bu yaklaşımın başarılı olabilmesi için çok sayıdaki engel aşılmalıdır.
Başlıca problemler, tam bir genin hücreye aktarılmasının kolay olmaması ve yeni genomla birleşmesindeki değişkenlik ve düzenlenmiş ifadesindeki nihai değişkenliğinden dolayı yeni genin kalıcı ifadesinin sağlanamamasıdır. Günümüze kadar birçok yaklaşım kullanılmış ancak hiçbiri tamamıyla başarılı olmamıştır. Bunlar; zayıflatılmış bir adenovirüs gibi viral bir vektör içerisine cDNA’yl paketleme ve hücrenin virüsü içine alma yeteneğini cDNA için bir araç olarak kullanma, cDNA’nın kalsiyum fosfatın indüklediği hücre membranından alınması ve hücre membranı ile füzyon yapabilen lipozam içine alınmış cDnA’nın hücreye aktarılmasıdır. cDNA, hedef hücreye başarılı bir şekilde aktarıldıktan sonra gen ürününün büyüklük ve sürekliliği önemli değişkenlerdir.
Gen ifadesinin (ekspresyonunun) büyüklüğü, hücre tarafından alınan cDNA’nın kopya sayısı ve hücre genomu ile birleşen (integre olan) cDNA miktarı tarafından belirlenir. Gen ifadesinin sürekliliği ise dizinin ve protein ürününün antijenitesine kısmi olarak bağIı olarak görülmektedir. Bu teknik sınırlamalara rağmen, gen tedavisi adenozin deaminaz eksikliğini tedavi etmede başarıyla kullanılmaktadır ve buda tedavinin dayandığı prensibin kabul edilebilir olduğunu ortaya koymaktadır. Gen tedavisinin klinik denemeleri, beklenmedik ölümlerin hem bilimsel hem de bilimsel olmayan medyada geniş bir şekilde yer almasından sonra epey yavaşlamıştır. Diğer genetik bozukluklar ve tedavi edici bir proteinin ekspresyonunu uyarma (örn., VEGF) üzerine yapılan çalışmalar devam etmektedir.
Hastalıkların moleküler temellerinin anlaşılması, özgül hastalık hedeflerinin belirlenmesine sebep olmuştur.
Bu prensibin son örnekleri, tedavi edilmesi zor olan hastalıklar için yeni tedavilerin geliştirilmesine sebep olmuştur. Bcr-abl kinazın hareketini bloke etmede özellikle etkili olan bir tirozin kinaz inhibitörü olan imatinib, kronik faz KML’nin tedavisinde oldukça etkilidir. Tümör nekroz faktör-a için monoklonal antikor (inflimimab/infliximab) veya çözülebilir tümör nekrozis faktör-a reseptör (etanercept), romatoid artrit ve enflamatuar bağırsak hastalıklarını içeren kronik enflamatuar bozuklukların tedavisinde etkili olarak kullanılan biyolojik değiştiricilerin (modifiye edicilerin) ilk örnekleridir.
Moleküler tedavi edicilere bu yaklaşım hızlı bir şekilde artmaktadır ve bir çok hastalığın tedavisi için ümit ışığı olmaktadır. Kanserle bağlantılı kategorilerin (örneğin DNA, RNA tamiri) ötesinde, gen ekspresyon çalışmaları klinik olarak ilgilenilen düzenleyici yollardaki ek etkileşimleri göstermiştir. Mikro dizileme kullanılarak gen ifadesi profilinin belirlenmesinin sınırlaması, transkripsiyon ve translasyon sonrası modifikasyonların gösterilmesi için proteomiksteki yaklaşım ve ilerlemelerle muhtemelen aşılacaktır.
Sinyalizasyon yolağındaki böyle işlemler saniyelerle haftalar arasında gen ekspresyonunu azaltabilir veya artırabilir. Tümörleri başlatan ve ilerleten yollara dair mevcut bilgileri artırmak için hala birçok çalışma vardır. Regülasyonun temel yolakları, rasyonel ilaç dizaynı için bulunmalıdır ve hedef, kültüre edilmiş hücre dizi lerinin ifade profillerinden, insan örneklerinden ve insan hastalıklarının küçük hayvan modellerinden toplanan mekanistik anlayışlarla belirlenir. Bununla beraber farklı hücre türleri arasındaki doku heterojenitesi ve varyasyondan sorumlu olmasına rağmen, genomik ve sayısal birleşme için yeni sistemler yaklaşımı, tümörogenezisi ilerIeten yolların şifresini çözmede ümit verici görünmektedir.
Sırayla, biyologlar ve klinikçiler, ilerlemenin süresi, proanjiogenez ve immün kaçmanın kanıtlarını anlamada, ki hepsi metastatik potansiyel ve ilerlemesinde rol alır, bu araçlardan elde edilen bilgileri kullanacaklardır. İlaç yanıtının genetik belirleyicilerini tespit etmek için hangi potansiyel tanısal araçlar mevcuttur? Mikro dizileme, proteomiks analizleri ve biyobilişim (biyoinforınatik) ile kombinasyon halindeki İnsan Genom Projesinden genom yaklaşımları, ilaç hedeflerini (örn., reseptörler) kodlayan birçok geni belirleyecektir. Benzer yüksek tarama metotları ile tarama, genetik polimorfizime bağlı tedavi yan etkilerine yatkınlıkta yeni bulgular sağlar.
Farmakogenetiğin geleceği, ilaçların yan etkisini etkileyen tüm faktörlerin bilinmesidir. Böylelikle, özel ilaç sınıflarının erken terkedilmesi, rasyonel ilaç dizaynı ve tedavisi lehine çevrilebilir. Farmakogenetiğin daha yaygınlaşması ve tıbbi uygulamaya entegre edilebilmesi için birçok engel aşılmalıdır. Tıbbi uygulamada mevcut deneme yanılma yaklaşımları, hekimler tarafından iyice bilinmelidir. Buna ek olarak, farmasötik endüstri tarafından başarılı ilaçların çekiciliği yaklaşan bireyselleşmiş dozlar için yeni bir modele garanti verir. Moleküler biyoloji ve genetik dalındaki hekimler için yeni eğitimler, kanıt temelli tıp çağında etkinliği belirleyen klinik farmakogenomjk çalışmaları tamamlamaııdır. Farmakogenetik polimorfizmler
için, ek olarak klinik değişkenler olmazsa böbrek işlevi gibi sadece tek teste ihtiyaç vardır, idealolarak yenidoğanda yapılmalıdır. Tedavi optimizasyonunun çok genli modelleri, genetik bilgi ve ek maliyetlerin kötüye kullanılma ihtimalini azaltan engellerle hala karşı karşıya gelirler.
Diğer taraftan, SNP haplotipleme, popülasyonun genetik olarak benzer alt gruplarının ayırt edilmesi ve daha güçlü genetik belirteçIerin temelinde randomize tedaviler için önemlidir. Popülasyon düzeyinde, genomik çeşitlilik farklı ırk ve etnik gruplar arasında çok daha büyüktür. Hem tedavi edici etkinlik ve hem de konak toksisitesi, hastanm özgül hastalığı, yaşı, böbrek işlevi, beslenme (nutrisyonel) durumu ve diğer ortak hastalık faktörleri tarafından etkilenir. Kanser, hipertansiyon ve diyabeti olan hastalar için ilaç tedavilerinin seçimleri ve algoritmaları için yeni problemler yaşanacaktır. Çoklu sistem hastalıklarının tedavisi (örn., metabolik sendrom), bireysel, etkileşen ve tamamlayıcı moleküler yolaklara dayanan yeni ilaçlara dayalı tasarlanabilir.