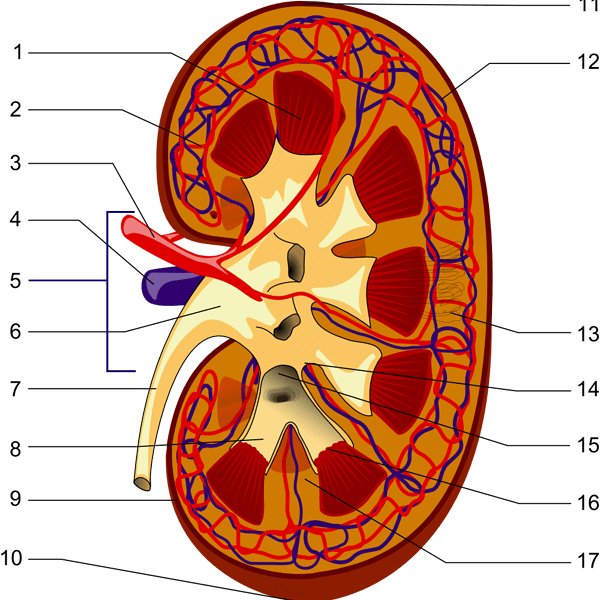
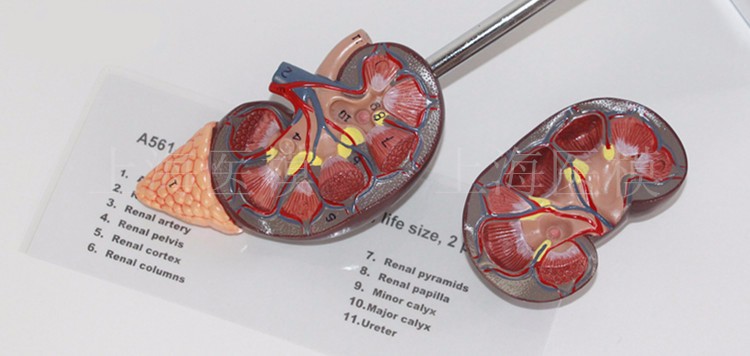
Böbrekler aşağı torasik ve yukarı lomber vertebra seviyesinde, vertebral kolonun her iki yanında retroperitoneal olarak yerleşmiş fasulye şeklinde bir çift organdır. Sağ böbrek karaciğerden dolayı sola nazaran hafifçe daha aşağıda bulunur. Yetişkine ait bir böbrek yaklaşık olarak 120-170 gram ağırlığında ve 12x6x3 cm ebatlarındadır. Böbreğin koronal kesitinde iki farklı bölge görünür. Soluk dış bölge (korteks) yaklaşık olarak i cm kalınlığındadır. Koyu iç bölge medulla olarak bilinir ve piramid olarak adlandırılan 6 ila 15 (ortalama 8) adet konikal yapı içerir. Her piramidin tabanı kortikomeduller bölgede yerleşiktir, piramidin tepesi ise papilla olarak bilinir ve böbreğin hilusuna doğru uzanır. Medulla dış ve iç zon olmak üzere iki bölgeye ayrılır. Dış bölge dış medullanın dış ve iç striplerini içerirken, iç bölge papillayı içine alır. Makroskopik olarak belirgin olan bu farklılık önemlidir, çünkü spesifik tübüler ve vasküler komponentIer her bölge için farklıdır, bunların tamamı gelecek bölümlerde anlatılacak olan böbrek fonksiyonlarında önemlidir. Böbreğin konkav medial yüzü renal hilus bölgesidir. Bu bölgeden, renal arter ve ven dalları, lenfatikler, sinirler ve üreterin renal pelvis olarak adlandırılan genişlemiş parçası böbreğe girer. Renal pelvis, böbrek içinde düz bir alanla bağlantı kurar, bu bölge renal sinus olarak adlandırılır. Renal pelvis, renal piramidIer içindeki birleşmiş toplayıcı kanallar yoluyla ortaya çıkan idrarı toplamak için major ve minor kaliksiere ayrılır.
Kan böbreklere birinci lomber vertebra hizasında, aortadan dallanan renal arter vasıtasıyla ulaşır. Renal arter hilusa gelir ve iki temel segmental dala ayrılır. Bu dallar böbreğin üst, orta ve alt bölgelerini besleyen birkaç lober artere ayrılır. Lober arterler renal parankime girdiklerinde dallanarak, meduller piramidierin lateral kenarları boyunca seyredip renal kortekse doğru ilerleyen interlober arterleri oluştururlar. Bu arterler kortikomeduller birleşim bölgesine gelindiğinde, kemer tarzında kıvrılarak daha küçük çaplı olan arkuat arterler şeklinde devam eder. İnterlobüler arterler, arkuat arterlerden doğar ve korteks içinde ışınsal tarzda ilerler. Glomerüler kapillerler, terminal interlobuler arterlerden kaynaklanan afferent arterioller yoluyla kan alırlar. Efferent arteriol, glomerüler kapiller yataktan ayrılır ve tubüler yapıları saran damar şebekesini oluşturur. Jukstameduller glomerüllerin efferent arteriolleri, vasa rekta olarak bilinen medullanın derinliklerine doğru uzanıp "U"şeklinde kıvrılan loopları oluşturur.
Böbrekler otonom sinir sistemi tarafından innerve edilirler. Sempatik sinir uçları renal vasküler yapı, tübüller ve jukstaglomerüler aparatın bütün segmentlerinde mevcuttur. Renal sempatik sinirlerin uyarılması jukstaglomerüler hücrelerden renin salınımını artırır, böylece angiotensin ve aldosteron üretimi artar. Böbreğin temel yapısal ve fonksiyonel birimi nefrondur. Bir böbrek yaklaşık olarak i milyon nefron içerir. Her nefronun 2 temel komponenti vardır: (i) kapiller bir ağ şebekesinden oluşan filtre edici kısım (renal korpüskül) (2) bağlantı tübülleri. Renal korpüskülün komponentlerinin çoğu glomerülün içinde bulunur. Bowman kapsülü glomerüler yumağı tamamen sarar. Bowman kapsülünden gelişen tübül komponentleri proksimal tübül (kıvrımlı ve düz kısmı vardır), Henle kulpu (proksimal tübülün düz kısrm, ince inen kol, ince çıkan kol ve medullar kalın çıkan koldan [MKÇK] oluşur) ve distal tübülü içerir. Distal tübül glomerüler polüne yakın seyreden kalın çıkan kolun kortikal segmentini, makula densayı, post-makula densa segmentini ve distal tübülün kıvrımlı parçasını içerir. Daha sonra toplayıcı kanal sistemi devam eder, bu sistemde ilk sırada bağlantı segmentleri vardır. Bağlantı segmentlerini toplayıcı kanallar takip eder. Toplayıc! kanalların kortikaL, iç ve dış medüller segmentleri vardır. Nefronlar sahip oldukları Henle kulpunun kısa ya da uzun olmasına göre sınıflandırılırlar. Kısa kulplu nefronlar genellikle süperfisyal ve midkortikal bölgelerden kaynaklanır ve bu Henlenin loopları dış medullada kıvrılır. Tersine uzun looplu nefronlar jukstameduller (kortikomeduller) bölgede yerleşiktir ve loopları iç medullaya kadar uzanır. Bu jukstameduller nefronların çok azı yukarı kıvrılmadan önce papillaya ulaşmak için iç medullayı penetre eden looplara sahiptir.
Glomerül epitelyal bir yapı (Bowman kapsülü) ile çevrelenmiş afferent ve efferent arterioller arasında asılrmş kapiller ağ şebekesidir. Kapillerler glomerüler yumak olarak adlandırılan lobüler yapıları oluşturur ve bu kapillerler ince bir tabaka endotelyal hücrelerle döşeIidir. Glomerülün merkezi mesangial hücre ve onu çevreleyen mesangial matriksten oluşmuştur. Glomerülün diğer komponentleri, glomerüler bazal membranı, visseral ve pariyetal epitel hücreleridir. Afferent ve efferent arterioller glomerüle vasküler bir uçtan girer ve çıkarlar. Bowman kapsülü üriner alanda proksimal tübülolarak devam eder. Efferent arteriol, peritübüller kapiller şebekeyi oluşturmak için ilgili tübülleri saran diğer bir kapiller ağ şebekesine ayrılır. Bu nedenle renal korpüskül Bowman kapsülünün pariyetal epiteli, glomerüler ağı saran visseral epitel, kapillerleri döşeyen endotelyal hücreler, glomerül bazal membranı ve mesangial matriks içinde yerleşik olan intraglomerüler mesangial hücreleri içine almaktadır.
Visseral epitelyal hücreler (veya podositler) kompleks bir yapıya sahip ileri derecede özelleşmiş perisitlerdir. Ayaksı çıkıntılar olarak adlandırılan, glomerül endotelyum yüzeyine doğru olan parmaksı uzantıları bu hücrelerin belirgin yüzey özelliklerinin en jyi örneğini oluşturur. Ayaksı çıkıntılar arasında slit diyafram adı verilen açıklıklar vardır. Podosit yapısındaki bozukluklar ayaksı çıkıntıların retraksiyonuna veya silinmesine ve proteinüriye yol açar. Bu değişiklikler bütün ilerleyici böbrek hastalıkları için karakteristiktir. Nefrotik sendromun konjenital formlarında çeşitli genlerde mutasyonlar gösterilmiştir. Bu genlerin ürünlerinin ayaksı çıkıntılar üzerinde bulunduğu bilinmektedir. Genin mutasyona uğramasıyla ortaya bozuk ürünler çıkmakta ve bu durum ayaksı çıkıntıların normal fonksiyonunu bozarak proteinüriye neden olmaktadır. Podositler, proteinürinin belirgin özellik olduğu böbreğin kazanılrmş hastalıklarının çoğunun primer bir hedefi gibi gözükmektedir. Fenestrah (delikli) endotelyal hücrelerin ince bir tabakası glomerüler kapillerleri döşer. Bu fenestralar vücutta mevcut olanların çoğundan daha büyüktür ve kısmen insan glomerüllerin yüksek ultrafiltrasyon katsayısından sorumludur. Endotelyal hücrelerin yüzeyi polianyonik glukoproteinlerden zengindir. Bu hücre yüzey yapısı albümin gibi negatif yüklü proteinlere karşı glomerülerün düşük geçirgenliğinden sorumludur. Vücudun başka bölgelerinde olduğu gibi, bu endotelyal hücreler koagülasyon, enflamasyon ve vazomotor tonusu kontrol eder. Endotel hücreleri klas 2 histokompatibilite kompleks yüzey antijenlerini ve lökositler için adezyon moleküllerini eksprese ederler. Faktör TXa ve Xa’yı bağlar, von Willebrand faktörü salar ve bağlar, endotelini ve nitrik oksiti sentez eder ve salgılarlar.
Glomerül bazal membranı birbirleriyle birleşmiş kollajen fibrillerini (tip LVve tip V kollajen) kapsayan glikoproteinlerden oluşmuş hidrate bir jel tabakasıdır. Heparinden zengin glikoproteinleri parçalayan heparinazlar, anyonik proteinlere karşı bazal membranın geçirgenliğinde Arteriollerin giriş ve çıkışları noktaları arasındaki bir alanda glomerüle sıkıca bağlı olan bir yapı makula densa olarak adlandırılan distal tübül hücre plağını tarif eder. Temas eden arteriollerin özelleşmiş granüler hücreleri ve mezangiumun matriksiyle birlikte olan bu farklı hücreler jukstaglomerüler aparatı oluşturur. Değişen tuz sunumu şartlarında bu bölge glomerüler filtrasyonu düzenler, bu sayede bu bölgeye geçen NaCl akışı tübüloglomerüler feedback olarak adlandırılan bir işlemle sabit tutulur. Yapı aynı zamanda reninin üretildiği bölgedir. Renin oluşumu tuz konsantrasyonuna duyarlıdır. Jukstaglomerüler aparat hücreleri sempatik nöronlarla zengin bir şekilde innerve edilir. Glomerül, ultrafitratı renal tübüller içerisine akıtır. Proksimal tübül, glomerülün üriner ucundan başlar ve iki kısımdan ibarettir. Birinci kısım (proksimal kıvrımlı tübül) kortekste yerleşiktir. İkinci kısım (proksimal tübülün düz kısmı) medullada yerleşiktir ve Henle kulpunu oluşturmak üzere medullaya ilerler. Henle kulpunun ince inen kolu medullada “U” şeklinde kıvrılır ve kortekse doğru döner (distal tübülü oluşturmak üzere). Distal tübülde iki kısımdan ibarettir: (1) Henlenin kalın çıkan kolu, (2) distal kıvrımlı tübüL. Distal tübül bağlantı segmentine dönüşür ki, burası distal tübül ile toplayıcı segment arasında geçiş bölgesidir. Toplayıcı segment kortikal toplayıcı kanallar ile iç ve dış medullar toplayıcı kanalları kapsar. Toplayıcı kanalların bu segmentleri sadece bölgesel dağıııma göre birbirinden ayrılmaz. Aynı zamanda her segmentte bulunan hücre toplulukları, her segmente spesifik transporter dağılımı ve transportu regüle eden hormonlara verilen cevaplara göre de farklılık gösterirler. Toplayıcı kanallar papiııer toplayıcı kanallar olarak veya renal papillanın uç kısmında renal pelvis içine boşalan bellini kanalları olarak sonlanır.
Böbreğin temel fonksiyonları vücut sıvı kompozisyonunu düzenlemek (eritrosit kitlesini de içererek), metabolizmanın artık ürünlerini ve ksenobiotikleri eksrete etmek, kalsiyum ve fosfat mekanizmasını ayarlamaktır. Filtrasyon, geri emilim ve sekresyon vücut sıvı kompozisyonunun düzenlenmesinde temel faktörler olmakla birlikte, böbreğin elektralit metabolizması ve kan basıncını kontrolüne katkıda bulunan hormon ve lipidleri sentez, metabolize ve sekrete etme kapasitesi daha az belirgindir. Bu kompleks işlem de ilk basamak glomerüııer de plazmanın ultrafitratının oluşturulmasıdır. Hücresel elementleri ve plazma proteinlerinin çoğunu barındırmayan bu sıvı, metabolizma ve diyetle değişen vücut sıvı ve iyonik kompozisyonunu yeniden oluşturmak için geriemilim ve sekresyon işlemlerinin yapıldığı çeşitli tübüler segmentlerde ilerlemeye devam eder. Nefron yapılarının her birinin bu dengenin başarılmasına nasıl
katkıda bulundukları aşağıdaki bölümlerde anlatılmıştır. Kardiyak outputun yaklaşık olarak 1/5’i böbreklere ulaşır. Bu miktar vücutta bulunan herhangi bir organın ağılığına göre aldığı en yüksek kan akım miktarını ifade eder. Glomerüller dakikada böbreğe ulaşan kanın yaklaşık olarak 1/4’nü filtre eder. Kan hücreleri ve proteinler filtrasyon bari yerinden geçemez. Geri kalan kan peritübüler kapiller şebekeye geçer. Peritübüııer kapiller şebekedeki yüksek onkotik basınç filtrattan kana doğru sıvı geri emilimine ve böylelikle sıvı geri dönüşüne yardımcı olur. Meduııa (vasa rektanın özelleşmiş kapillerleri yolu ile postglomerüller kandan kendi kanının alu) renal kan akımının sadece % 15’ ini alır. Normal böbrek, böbrek kan akınunı kontrol etme yeteneğine sahiptir. Geniş bir arteriyel basınç aralığında kan akımı sabit tutabilir. Arteriyel basınç arttığı zaman sistem afferent arterioldeki direnci arttım ve efferent arterioldeki direnci azaltır. Oysa arteriyel kan basıncındaki bir düşme afferent ve efferent dirençte zıt değişikliklere neden olur. Perfüzyon basıncındaki değişikliklere arteriollerin doğal reaksiyonu ve tübüloglomerüler feedback sisteminin çalışması normal fizyolojik koşullar altında bu otoregülatuar ayarlamalara katılırlar. Bununla birlikte hastalıklı böbrekte bu işlem ciddi bir şekilde sınırlanmıştır.
Kanın ultrarafıItratı glomerülde oluşturulur. Glomerül diğer kapiller yataklarda olduğu gibi Starling kuvvetleriyle yönetilir. Glomerüler dolaşım yüksek filtrasyon oranları için uygundur. Afferent ve efferent arterioller tarafından oluşturulan yüksek ultrafiltrasyon basıncı, filtrasyon bariyerinin yüksek hidrolik permeabilitesi, glomerül kapillerlerin kıvnmlı seyri (filtrasyon için gerekli yüzeyalanını artırır) tübül kompartmanına geçen sıvı hacminin fazla olmasını sağlar. Normal glomerül filtrasyon hızı (GFR) vücut yüzeyi, yaş, diyet ve fizyolojik koşullara bağlı olarak değişir. GFR bayanlar için 100 ml/dk, erkekler için 120 ml/dk değerindedir. Gebelik GFR’de artmaya neden olur. GFR’nin en doğru ölçümünü inülin klirensi gösterir. Bu yöntem laboratuar bağımlıdır. Bu nedenle tarama amacı ile kullanılması uygun değildir. Bunun yerine GFR’deki değişiklikleri tahmin etmek için daha sıklıkla serum kreatinin ve endojen kreatinin klirensi kullanılır. Glomerüler fonksiyondaki çok sayıdaki değişiklik GFR’de azalmaya neden olabilir. Bu durum böbrek hastalığının bir işaretçisidir. Bu değişiklikler, kronik renal hastalıkta görülen nefron sayısındaki azalma, şoktaki glomerül perfüzyon basıncındaki azalma, afferent arteriol direncinde spesifik yükselme ve üriner obstrüksiyon ile idrar akımının obstrüksiyona uğramasını içerir. Ciddi kalp yetmezliğinde görüldüğü üzere hidrostatik basınçta düşme olmaksızın kan akımındaki azalma efektif net ultrafiltrasyon basıncının azalmasıyla GFR’yi düşürür. Primer ya da sekonder olsun renal hastalık bu mekanizmaların farklı kombinasyonları ile filtrat oluşumunu bozar.
Glomerüler filtrat idrar oluşturmak için nefrondan aşağı doğru seyrettikçe değişikliğe uğrar. Filtratın ve onun içeriğinin net emilimi sodyum, klor, su, bikarbonat, glukoz, aminoasit, fosfat, kalsiyum, magnezyum, ürik asit ve diğerleri tarafından en iyi şekilde karakterize edilir. Hidrojen iyonu (H+), amonyum (NH4+) iyonu ve çok miktardaki organik asit ve baz ise filtrata eklenir. Üre ve potasyum her iki olaya da maruz kalır. Net sonuç altta yatan fizyolojik durum ve diyete bağlıdır. Renal tübülün en Çarpıcı özelliklerinden birisi onun hücresel heterojenitesidir. Bu farklılıklar transport özelliklerini belirler. Her segmente özelolan transport proteinleri ve transportu inhibe eden ilaçlara verilen cevaplar bu heterogeniteyi en iyi şekilde temsil eder. İdrarı modifiye etmede her segmentin rolü ayn olarak tartışılacaktır. Proksimal tübül, filtre edilen sodyum, klor, su, üre, potasyumun %60’lnı ve bikarbonatın %90’nı geri emilimini gerçekleştirir. Bu yüksek emilim oranları kan ve filtrat arasındaki ozmotik gradyentlerde tespit edilebilir bir farklılık olmaksızın başarılır. Filtre edilen glukoz ve aminoasitlerin hemen tamamı proksimal tübül boyunca
filtrattan geri alınır. Fosfatlar bu alanda geri emilirler ve bu transport rotasının aktivitesi paratiroid hormondan belirgin olarak etkilenir. Proksimal tübül etrafında bu solidlerin primer transport mekanizmaları bazolateral membranda bulunan sodyum-potasyum adenozin trifosfat (Na+, K±ATPaz) aracılığı ile primer aktif transportla ve proksimal tübülün lüminal fırça kenar membranıannda dağılmış olan sekonder aktif transport mekanizmaları ile eşleşerek sodyumla bağlantı kurar. Büyük miktarda transepitelyal kitle akışını kontrol eden proksimal tübülün temel yapı özelliği lüminal membranın geniş fırça kenandır. Fırça kenarlar membran alanını belirgin bir şekilde genişletir. Renal epitelin bu polaritesi nefron boyunca taşıyıcı transportun başarılmasında temel unsurdur.
Transport yapan epitele atfedilen diğer yapısal özellik junctional kompleks (bağlantı bölgeleri) olarak adlandırılan hücrelerin bağlandığı, oldukça ileri derecede özelleşmiş bölgelerin varlığıdır. Bu kompleksler apikal yüzeyde bulunur ve sadece hücreleri bağlamak ve polariteyi devam ettirmekle kalmaz, aynı zamanda bir paraselüler transport yolu ile su ve solitlerin geçebildiği potansiyel bir boşluk oluşturur. Sızdıran bir epitelyum olarak proksimal tübülün elektriksel sınıflaması junctional kompleks yapılarının spesifik özellikleri ile belirlenir. Bu kanallar yolu ile suyun hareketi ve solütler için farklı seçicilik, belirgin su ve tuz hareketinin sağlandığı solvent drag etkisini tesis eder. Junctional kompleksin protein elementleri bozuk olabilir ve paraselin mutasyonunun üriner kalsiyum ve magnezyum kaybından sorumlu olduğu düşünülen hipomagnezemik hiperkalsüri sendromunda gösterilen konjenital hiperkalsüri gibi transport defektierine neden olur. Proksimal tübüldeki bikarbonat ın yeniden emilimi belki de en iyi olarak fonksiyonel ilişkilerin mükemmel etkinliği ile tanımlanabilir. Protonlar fırçamsı kenarda bulunan Na±H+ değiştiricisi (NHE) ile lümen içine salınırlar. Taşıyıcı siklik adenozin monofosfat (cAMP) yolu ile düzenlenir. cAMP’ın etkisi NHE ilişkili faktör (NHERF) ve hücre çatısı arasındaki spesifik yapısal ilişkilere bağlıdır. Na±K±ATPaz’ın etkisi ile tesis edilen sodyum gradyentinde depolanmış olan potansiyel enerji bu değişimi yönetir. Bu nedenle oluşan HC03- Na±HCO-3 yardımcı taşıyıcı aracılıyla sodyuma eşlik ederek bazolateral membranın karşısına geçer. Sistemin etkili çalışması karbonik anhidrazın iki izozimi ile kolaylaştırılır. İzozimlerden biri lüminal membran üzerindedir ve lümen içine hidrojen atılımı ile oluşan karbonik asiti dehidrate eder, diğeri hücre içinde bulunur, hücreden hidrojen ÇıkıŞı ile oluşan hidroksil iyonlarından bikarbonat oluşturur.
NHE’nin çalışması proksimal tübülün apikal membranında format-Cr değiştiricisi ile eşleşince net sonuç NaCl geri emilimi olmaktadır. Böylece bu taşıma işleminin kutupluiuğu ve onların eşleşmeleri düşük enerji tüketiminde etkili proton salınımı, sodyum klorür ve sodyum bikarbonatın yeniden emilimini gerçekleştirir. Proksimal tübülün düz kısmında ürik asit gibi organik asitler ve penisilin gibi ilaçlar salınır. Diüretiklerin çoğu da yine bu nefron segmentinden salındıktan sonra nefronun aşağı bölgelerindeki lüminal solüt aktarımını engeller. Dahası renal asit atılımında önemli bir basamak olan amonyak sentezi de proksimal tübülde görülür. Tübülü çevreleyen fiziksel kuvvetler proksimal tübülde solut ve su geri emilimini de yönetirler. Örneğin yüksek peritübüler kapiller hidrostatik basınç proksimal tübülden su ve sodyumun yeniden emilimini bozar. Tersine peritübüler kapillerlerdeki yüksek kolloid onkotik basınç, proksimal tübülden su ve elektrolitlerin geri emilmesini sağlar. Bu fiziksel kuvvetlerin temel belirleyicisi filtre olan glomerüler plazma parçası veya filtrasyon fraksiyonudur. Miktar, volüm yüklenmesinde ve düşük kalp yetmezliğinde yüksektir. Henle kulpu kortikomeduller bölgede başlar. İnce inen kol daha sonra U şeklinde bir kıvnm yapar ve ince çıkan kololarak devam eder. Yapı dış medulla seviyesinde medüller kalın çıkan kol (MKÇK)'u yapar ve kaynaklandığı glomerül seviyesinde maküla densada sonlanır. Henle kulpunun her segmenti sodyum klorür ve su için farklı geçirgenliğe sahiptir. İzoozmotik ultrafiltrat hacminin yaklaşık olarak %l5’i ve yaklaşık olarak sodyum klorürün %25’i emilir. İnce inen koldaki pasif su emilimi ve ince çıkan koldaki tuz emilimi bu segmentlerin seçici geçirgenliğinin bir sonucu olarak meydana gelir. Bu farklı emilim proksimal tübüle giren isotonik sıvıyı distal tübüle sunulan dilüe sıvı haline çevirir.
Tübüler sıvıyı dilüe etmede ve yüksek medüller interstisyel solüt konsantrasyonu oluşturmada majör katılımcı MKÇK’dur. MKÇK, aktif enerji bağımlı bir etki ile sodyum klorür emilimini sağlar. Spesifik olarak lümjnal transport Na±K±2Cr yardımcı taşıyıcısını (NKCC2) içerir. Hücreden klor çıkışı, aktivitesi hücre içi klor konsantrasyonunun yükselmesi ile artan klor kanalları yolu ile olur. Yardımcı taşıyıcı yolu ile hücreye giren potasyum lüminal membranda bir potasyum kanalıyla yeniden kazanılır ve bazı fonksiyonları destekler. Yardımcı taşıyıcı aktivitesini devam ettirir, potasyum salınımını mümkün kılar ve katyon seçici paraselüler yolla sodyum, kalsiyum ve magnezyum emilimini idare eden pozitif transselüler bir potansiyel oluşturur. Bu katyon seçiciliği özgül paraselüler protein olan paraselin ile belirlenir. Bu proteinlerin her birindeki genetik defektler Bartter sendromunun tipik fenotipik özelliklerini gösteren hastalarda bulunur. Bu segment suya geçirgen olmadığından, kalın çıkan koldan ayrılan lüminal sıvı aktif tuz emilimi ile plazmaya göre hipotonik yapılır, bu işlem idrar dilüsyonunda kritik bir basamaktır. Meduller interstisyuma sodyum klorür eklenmesi antidiürez boyunca toplayıcı kanallardan ve ince inen kollardan su emilimi için gerekli interstisyel hipertonsiteyi oluşturan ve devam ettiren çoğaitıcı bir işleme izin veren primer basamaktır. Furosemid yardımcı taşıyıcının güçlü bir engelleyicisidir. Antidiüretik hormon (ADH) hücredeki cAMPyi artırarak kalın çıkan koldaki NaCl transportunu artırır. Oysa prostaglandinler ADH’nın indüklediği artmış hücre içi cAMP içeriğini ve sodyum klorür taşınmasını engeller. Yeni tanınan düzenleyici rol kalsiyuma duyarlı reseptörün aktivasyonu ile ortaya çıkar. Bu reseptör potasyum kazanımını azaltarak sodyum klorür taşıyıcısını engeller ve idrar konsantrasyonunu düşürür. Bu sonraki fonksiyon yüksek kalsiyum alım dönemlerinde üriner taş oluşumunu engellemek için önemlidir. Lupun U şeklindeki yapısı ve karşılıklı akımı korteksin izotonik yapısı ile karşılaştırıldığında yüksek interstisyel ozmalireteyi devam ettirmeye yardım eder. Vaza rektanın benzer bir organizasyonu Henle kulpundan emilmiş sodyum klorürün ve papiller toplayıcı kanallardan emiImiş ürenin interstisyumda tutulmasını sağlar ve interstisyel osmolaliteyi daha da artırır. Kalsiyum geri emiliminin önemli bir kısmı Henle kulpunda görülür. Kalın çıkan kolun medüller kısmındaki kalsiyum emilimi, aktif tuz emilimi ile oluşmuş pozitif lüminal transepitelyal voltajın büyüklüğü ile değişir ve kalsiyum emilimi seçici paraselüler yolla gerçekleştirilir. Henlenin kalın çıkan kolu magnezyum geri emilimi içinde majör bir alandır ve muhtemelen benzer bir mekanizma ile çalışır.
Distal nefron üç segmente ayrılabilir: (I) distal kıvrımlı tübül, (2) transizyonel epitelden oluşmuş bağlantı tübülü, (3) toplayıcı kanallar. Korteksteki toplayıcı kanallar interkale (ara) ve esas hücrelerden ibarettir. Oysa medulladakiler özellikle esas hücrelerden oluşmuştur. Distal kıvrımlı tübül kalın çıkan kol tarafından başlatılan lüminal sıvının dilüsyonunu devam ettiren, suya geçirgen olmayan bir nefron segmentidir. Distal kıvrımlı tübülde sodyum emilimi başlıca tiazid diüretiğine duyarlı CI- ile eşleşmiş bir yardımcı taşıyıcı ile gerçekleştirilir. Bu taşıyıcı kalın çıkan kolda bulunana benzer fakat potasyuma bağımlı değildir. Sodyum klorür yardımcı taşıyıcısındaki genetik defektler Gitelman sendromundan sorumludur. Bu segment kalsiyum dengesinin sağlanmasında da önemlidir. Çünkü PTH ve Vitamin D kalsiyum taşınımını burada artırır. Lüminal kalsiyum alımı (üminal membrandaki kanallar yolu ile devam ettirilir. Bu kanallara kalsiyum girişi büyük bir elektrokimyasal gradyentle gerçekleştirilir. Aktif bir işlem olan kalsiyum çıkışı başlıca Na±Ca+ değiştiricisi ve az bir dereceye kadar Ca±ATPaz yolu ile yürütülür. ÇıkıŞ basamağı, PTH düzenlenmesinin görüldüğü majör bir alandır. Bu segmentteki sodyum taşınması ADH veya aldestrondan etkilenmez. NaCl yardımcı taşıyıcısının engellenmesi (örn., tiazid diüretikleriyle), kalsiyum girişini artırarak azalmış sodyum klorür girişinin bir sonucu olarak görülen kalsiyum çıkışına neden olarak kalsiyumun yeniden emilimini artırır. Toplayıcı kanallar bağlantı tübülü ile başlar. Bağlantı tübülleri distal tübül ve kortikal toplayıcı kanalın taşıyıcı özelliklerine sahiptir. Toplayıcı kanal epitelinin fonksiyonel yönleri su ve tuz dengesini gerçekleştirmek içinkritik role sahiptir.
Volüm eksikliği ve maksimum aldosteron üretimi durumlarında idrar neredeyse sodyum içermeyen bir şekilde çıkarılabilir. Toplayıcı kanalın ilk veya kortikal bölgeleri esas ve interkale hücrelerin bir karışımı ile döşenmiştir. Medulla içine doğru gidildikçe interkale hücrelerin sayısı azalır, iç meduHanın ilk kısmından daha aşağıdaki toplayıcı kanaııarda interkale hücre bulunmaz. Transepitelyal Na+ geri emilimi [üminal membrandaki epitelyal Na+ kanallarının ve bazolateral Na+, K+ ATPaz’ ın çalışması ile gerçekleştirilir. Aldosteron, ADH’nın yaptığı gibi bu segmentteki sodyum taşınma hızını artırır. Oysa prostaglandinler ve natriüretik peptik sodyum taşınmasını azaltır. Aldosteron her bir membrandaki potasyum kanaııarı vasıtasıyla net potasyum salınımını uyararak bazolateral membranı hiperpolarize de eder. İnterkale hücreler sodyum geri emilimi ve potasyum salınımına katılmaz fakat bunun yerine asit-baz dengesine katılır. İki tip interkale hücre mevcuttur. Birinci tip asit salgılar. Oysa ikinci tip baz salgılar (taşıyıcı proteinlerin kutupluluğuna bağlı olarak). A tip hücre filtre olmuş bikarbonatın geri kalan kısmını tutar ve proton salınımı vasıtasıyla amonyağı içeren üriner tamponların nihai titrasyonunu gerçekleştirir. Bir H+ ve bir H+, K±ATPaz’ın ikisinin birden mevcudiyetine dair deliller bulunmuştur. Bazolateral bikarbonat çıkışı bir anyon değiştiricisi yardırruyla klor değişimi yapılarak gerçekleştirilir. Hücreye giren klor, klor kanllarıyla dışarı çıkarılır. Proton pompası ve anyon değiştiricisinin bu kutupluluğunun tersine çevrilmesi B tip interkale hücrelerde bikarbonat salınımına neden olur, fakat bu hücreler iç medullanın iç bölümünde kaybolur. Aldosteron sodyum geri emilimini başlatarak ve lümendekj elektronegatifliği artırarak idrar asidifikasyonunu uyarıro Volüm artışı ve diüretik kullanımında görüldüğü gibi bu alanlara artmış sodyum sunumu bu bölgedeki sodyum taşınmasını uyararak proton atılımını başlatır.
İç medüller toplayıcı kanalların (İMTK) epitelyal hücreleri daha uzundur ve dış medüller taplayıcı
kanalda (DMTK) bulunanlardan daha az mitokondriye sahiptir. Ek olarak burada ADH ile uyarılan, üre ve sıvı transferini kolaylaştırdığı tespit edilen farklı özelliklere sahip bir lateral interselüler alan mevcuttur. Bu bölgede atrial natriüretik peptit (ANP) gibi natriüretik peptitlerle aktive edilen inhibitör cGMP’ye yanıtlı ENaC proteinleri de bulunur. Bu bölge escape (kaçış) fenomeninin gerçekleştiği yerdir. Bu fenomende; volüm artışıyla oluşan atriyat gerilme, ANP salınımına, toplayıcı kanal sodyum transportunun baskılanmasına ve natriüreze neden olur. Diğer anahtar düzenleyici nitrik oksittir. Nitrik oksİl cGMP vasıtasıyla ENaC’larını da inhibe eder. Konjestif kalp yetmezliğinde bu sistemlerin yetmezliği ödem oluşumunun önemli bir belirleyicisidir. Bu alan gelecekte yararlı terapötik bir hedef olabilir. Potasyum salınımı, Henle kulpunun ince inen kolunda başlayabilir, ancak salınım toplayıcı kanallarda daha belirgindir, buna bağlı olarak idrarla atılan potasyum çoğunlukla toplayıcı kanallarda görülen salınımla idrara geçer. Pek çok faktör potasyum salınımını etkiler. Bunlar; apikal ve peritübüler faktörler olarak sınıflandırılabilir. K+ salınımını belirleyen temel apikal faktör tübül akış hızıdır. Tübül akış hızı lümendeki K+ konsantrasyonunu düşürür ve konsantrasyon gradyentinin etkisiyle hücre içi K+ tübüler lümen içine difüzyona uğrar. NaCl ile oluşturulan hacim artışı toplayıcı kanallara sodyum sunulmasını artırır. Toplayıcı kanallar Na geri emilimini uyarır ve lümendeki elektronegativiteyi arttır. Lümendeki artmış zayıf asitler ve azalmış klor konsantrasyonu K+ salınımını artırır. Oysa lümen içindeki asidite K+ salınımını engeller. Çalışmalar son belirtilen etkinin luminal membran K+ iletimindeki bir düşmeyle meydana geldiğini göstermektedir. K+ salınımını engelleyenler ya luminal membran potansiyelini depolarize eden Na+ kanal inhibitöderidir (triamteren ve amilorid gibi) ya da K+ kanalının kendisinin inhibitöderidir (baryum gibi). Potasyum taşınmasını etkileyen peritübüler faktörler; K+, H+ , HC03 - ve hormonlardır. Plazmadaki K+ konsantrasyonunun artması hem doğrudan olarak hem de aldosteron salınımını uyararak K+ salınımını arttırır. Aldosteron tarafından yapılan bu uyarı spironolakton tarafından engellenir. Distal K+ salınımı metabolik asidozda azalır ve metabolik alkalozda ise artar.
Distal nefronun azalmış su alıIlllna yanıt olarak su ve üre geri emilimini değiştirme yeteneğine sahipken, proksimal nefronda su geri emilimi göreceli olarak sabit karakterdedir. Distal nefron bu yeteneğini ADH’ ya cevap olarak nefron boyunca su ve üre için geçirgenlik özellikleri değiştirerek gerçekleştirir. Distal nefron hücreleri ADH yokluğunda su ve üreye karşı minimal geçirgendir, bu durumda distal kıvrımlı tübülde işlenmiş hipotonik (50 -100 mOsm/kg) sıvı değişmeden idrara geçer. ADH mevcut olduğu zaman su toplayıcı kanal tübül duvarını rahatlıkla geçer ve luminal sıvı tonisitesi interstisyumunkine yaklaşır. Bu nedenle idrarın maksimum konsantre edilebilme yeteneği ADH mevcudiyetine ve meduller hipertonisiteye bağlıdır. Meduller hipertonisite kalın çıkan koldan NaCl emilimi ve countercurrent (karşıt akım) sistem yoluyla tuz ve ürenin yakalanmasıyla oluşur. Ürenin özel bir rolü vardır, çünkü üre geçirgenliği toplayıcı kanallann sadece en terminal kısımlarında artırılır, su geri emilimini bu terminal toplayıcı kanalların proksimalinde bulunan alanlarda gerçekleştiğinden derin papillada depolanma için büyük bir gradyent sağlanmış olur . Medullada interstisyumun derinliklerine göç eden üre, countercurrent sistem tarafından yakalanır ve toplayıcı kanallar ile bu bölgeye uzanan ince inen koldan su Çıkarmak için ilave bir osmotik güç olarak etki yapar. Prostaglandinler bazı mekanizmalarla distal su geri emilimini bozar. Bu mekanizmalar toplayıcı kanallardaki ADH etkisinin bloke edilmesi ve meduller kan akımının artırı lmasıdır. Böylece nonsteroid antienflamatuar ilaçlar prostoglandinleri bloke ederek renal serbest su atılımını bozabilir.
Böbrek protein katabolizmasının nitrojenli ürünlerinin atılımından sorumludur. Bu atılım primer olarak glomerüldeki filtrasyonla gerçekleştirilir. Homeostazis bu ürünlerin düşük konsantrasyonunun devamını gerektirdiğinden, büyük miktarda ultrafiltrat oluşumu bu maddelerin atılımı için gereklidir. Günlük 180 L’lik GFR bu kitle atılımını mümkün kılar. Tübül sekresyonu (özellikle proksimal tübülün düz kısmında) toksinierin kandan temizlenmesi için diğer bir yoldur. Organik asitler (hippurat, ürat, laktat), organik bazlar (morfin) ve pek çok ksenobiyotik bu şekilde atılır. Salınım işlemleri protein bağımlı maddelerin atılımı için ana yolu oluşturur. Antibiyotikler ve diüretikleri içine alan pek çok ilaç bu mekanizmayla uzaklaştırılır. Böbrekler hipertansiyon oluşumunda önemli rol oynarlar. Tuz taşınmasının genetik hastalıklarıyla bu durum doğrulanmıştır. Bu rollerinin belki de en önemlisi ENaC’nin aktive olduğu Liddle sendromlu hastalarda keşfedilen fonksiyon mutasyondaki kazanımdır. Bu hastaların ciddi hipertansiyonu vardır ve erken başlangıçlı kardiyovasküler ya da serebrovasküler hastalık nedeniyle ölürler. Artan deliller esansiyel hipertansiyonda böbrekler tarafından sodyum atılımında primer bir bozukluğun olduğunu işaret etmektedir. Sodyum atılımındaki bu bozukluk damar içinde hacim artışına ve hipertansiyona neden olur. Ayrıca renovasküler hastalıkların bazı formlarında göründüğü gibi jukstagromerüler aparatın granüler hücreleri tarafından yapılan reninin aşırı üretimi de ciddi hipertansiyona neden olur.
Böbrekler tübüler hücreleri yoluyla çoğu hipofizer hormon ile glukagon ve insülini içeren çok sayıdaki peptit hormonun metabolik yıkımına katkıda bulunur. Diyabetli ve böbrek yetersizlikli hastalarda insülinin azalmış renal katabolizması hipoglisemi ataklarına neden olabilir. Böbrek eritropoietin üretimin majör bölgesidir. Bu hormon ileri derecede glikozile 39000 dalton ağırlığında bir proteindir. Eritropoietin renal kortekste üretilir fakat üretimi yapan hücreler tam olarak belirlenememiştir. Eritrapoietin kemik iliği üzerindeki etkisi ile eritrosit yapımını uyarıro Eritropoietin üretimi, doku oksijenasyonunun azaldığı durumlarda artar. Bu artış yüksek irtifada yaşayanlarda, akciğer hastalığı olanlarda veya kanı n azalmış oksijen taşıma kapasitesinin bir sonucu olarak görülen kronik hipokseminin bir sonucu olarak karşımıza çıkar. Böbrek sadece kalsiyum, fosfat ve asitin atılımını direkt olarak düzenlemekle kalmaz, aynı zamanda hormonal üretimi de etkileyerek kalsiyum dengesine katkıda bulunur. Vitamin D intestinal kalsiyum emilimini düzenleyen potent bir hormon olmak için iki enzimatik hidroksilasyona ihtiyaç duyar. Molekülün karaciğerde 2S pozisyonunda hidroksillenmesinden sonra renal proksimal tübüler hücreleri veya 24 pozisyonunda ikinci bir hidroksil iyonunu eklerler. Bu hidroksilasyon basamağı PTH veya düşük fosfatla kontrol edilir ve uyarılır. Daha önceden de belirtildiği gibi jukstaglomerüler hücreler renin üretir ve salar. Renin güçlü bir vazokonstriktör olan anjiyotensin II oluşumunu başlatır. Angiotensin II aldosteron salınmasını uyarır. Aldosteron da renal sodyum emilimini, hidrojen ve potasyum atılımını uyarır. Böbrek, glikoneogenetik yolla glukoz sentez etme yeteneği sayesinde plazma glukozunun düzenlenmesine katılır. Böbrek glukoneogenez için laktat, pirüvat ve amino asitleri kullanır. Bu işlev uzamış açlık dönemlerinde önemlidir. Bu dönemlerde böbrek, plazma glukozunun % 40’tan daha fazlasını oluşturur. Ciddi böbrek fonksiyon bozukluğu olanlarda bu glukoneogenetik yolun yokluğu diyabetli kişilerde hipoglisemiye katkıda bulunur.
Renal hastalığın ilerlemesinde podosit hasarının rolü gelecekte daha fazla incelenecektir. Majör tuz ve su taşınmasının detaylı üç boyutlu moleküler yapısı biyolojik membranıardan molekül transferini gerçekleştiren mekanizmaları ortaya koymakla kalmayacak. aynı zamanda onların düzenleyici proteinlerle nasıl etkileştiğini gösterecektir. Elde edilecek detaylı bilgiler bu tip hastalıkların tedavisinde yeni ajanlarının geliştirilmesine katkıda bulunacaktır.Tübüloglomerüler geri bildirim sisteminin daha detaylı anlaşılması akut ve kronik böbrek hastalığının tedavisi için önemli yaklaşımlar sağlayacaktır. Moleküler biyoloji ve moleküler genetik renal hastalıkların patofizyolojik mekanizmaları hakkında bilgi sağlamaya devam edecektir.
Böbrek hastalıklarının Amerika Birleşik Devletleri ve tüm dünyada yetişkin nüfusun yaklaşık olarak % 10’unu etkilediği tahmin edilmektedir. Böbrek hastalıklarının akut ve kronik formlarının çok yaygın olması, hekimlerin bu hastalıkların tanımasında daha dikkatli olmalarını gerektirir. Böbrek hastalıklı bireyler sinsi kronik böbrek hastalığında olduğu gibi kırgınlık, iştahsızlık ve yorgunluk şeklinde belirsiz semptomlar ya da akut böbrek yetmezliğinde görülebilen hipertansiyon, ödem, idrar miktarında değişiklik, hematüri veya koyu renkli idrar gibi belirtiler gösterebilirler. Retinopati veya nöropati gibi eşlik eden organ komplikasyonları ve hipertansiyon ya da diyabet öyküsü böbrek hastalığının sebebinin belirlenmesinde önemlidir. Benzer şekilde Alport sendromunda ailede böbrek hastalığı öyküsü, tekrarlayan böbrek taşıyla birlikte olan kronik obstrüksiyon, reflü nefropatisiyle birlikte olan tekrarlayan üriner sistem enfeksiyonu öyküsü böbrek hastalığının sebebinin belirlenmesinde yardımcıdır. Böbrek hastalığı belirlendiği zaman hikayede öğrenilmesi gereken diğer bilgiler otoimmün hastalıklarda ortaya çıkan artralji ve deri döküntüsü, postenfeksiyoz glomerülonefritte görülen ateş ve faranjit, akut ve kronik interstisyel nefritle ilişkisi bilinen ilaç (reçete edilebilen, yasadışı ilaçlar veya bitkiler) kullanımı olmalıdır. Böbrek hastalığının akut yada kronik olduğunun belirlenmesinde en önemli faktörlerden biri böbrek fonksiyonunun daha önceki bir değerlendirmesini elde etmek amacıyla eski tıbbi kayıtların gözden geçirilmesidir.Fizik muayene böbrek hastalığından sorumlu sistemik hastalığı ortaya çıkarabilir. Retinanın dikkatli bir muayenesi diyabet, hipertansiyon, bakteriyel endokardit ve kolestrol embolisi varlığını gösterebilir. Ek olarak ödem, döküntü ve purpuranın varlığı için cilt muayenesi, artrit bulguları için eklem muayenesi önemlidir. Erkeklerde rektal muayene, kadınlarda pelvik muayene üriner obstrüksiyona sebep olabilecek bir olayı dışlamak için önemlidir.
Glomerüler filtrasyon hızı serum kreatinin ve üre nitrojen konsantrasyonlarının ölçülmesi ile kolay şekilde belirlenebilir. Kreatinin majör bir kas elementi olan kreatinin bir metabolitidir. Bir bireyde kreatininin günlük üretim hızı sabittir ve iskelet kas kitlesi ile orantılıdır. Kreatininin neredeyse tamamı glomerüler filtrasyon ile uzaklaştırılır ve serumdaki kreatinin konsantrasyonu, böbrek fonksiyonun bir ölçüsü olarak kullanılır. Serum kreatinin konsantrasyonu için normal aralık erkekte 0.8-1.3 mg/dı, kadında 0.6-1.1 mg/dl dir. Kadınlardaki kas kitlesi erkeklere nazaran daha az olduğundan kadınlar daha az kreatinin üretirler, bundan dolayı da serum kreatinin değeri kadınlarda daha düşüktür. Bununla birlikte normal aralığa denk düşen bir kreatinin değeri her zaman normal bir böbrek fonksiyonunu işaret etmeyebilir. Örneğin, kreatinin değeri 0.6’dan 1.2 mg/dl’ye yükselen bir hastada kreatinin normal sınırlar içinde kalmasına rağmen GFR de %50 azalma söz konusudur. Simetidin, triamteren ve amilorid gibi bazı ilaçlar kreatinin atılımıyla etkileşerek serum kreatinin değerinde yalancı bir yükselmeye neden olabilir. Kan üre nitrojen (BUN) konsantrasyonu, böbrek fonksiyonun bir ölçüsü olarak serum kreatinin konsantrasyonuyla bağlantılı bir şekilde kullanılır. Üre protein metabolizmasının başlıca son ürünüdür, üre oluşumu diyetle protein alımı ve protein katabolizma hızını yansıtır. Glomerüler filtrasyon üreyi atar fakat ürenin önemli bir miktarı tübül boyunca geri emilir (özelliklede volüm azalması gibi sodyum açığının bulunduğu durumlarda). Sonuç olarak BUN değeri hücre dışı sıvı hacmi ile ilişkili olarak değişebilir. Oysa serum kreatinin konsantrasyonu hacim durumuna daha az bağımlıdır. Serumdaki üre nitrojeninin kreatinin konsantrasyonuna oranı normalde 50de1’dir. Bu oran pek çok klinik durumda artar.
Böbrek fonksiyonunu tahmin etmede tek başına kreatinin ve BUN kullanımının sınırlılıkları olması nedeniyle National Kidney Foundation ve Kidney Disease Outcomes Quality Initiative (KlDOQI) GFRyi tahmin etmek için kreatinin kIirens ölçümlerini öneren klinik pratik kılavuzlar geliştirdi. Kreatinin klirensi (Ccr) 24 saatlik idrar toplanmasıyla veya Cockroft-Gault formülü yada Modification of Diet in Renal Disease (MDRO) formülü ile matematikselolarak hesap edilebilir. iki önemli hata 24 saat idrar toplayarak Ccr hesaplanmasının doğruluğunu sınırlar: (1) artmJş kreatinin salınımı (2) idrarın tam toplanamaması. Normal böbrek fonksiyonuna sahip bireylerde kreatininin yaklaşık olarak % LO u proksimal tübül hücrelerden idrar içerisine salınır ve bu oran böbrek hastalıklı bireylerde artabilir. Bu nedenle gerçek GFR’nin hatalı bir şekilde yüksek olarak değerlendirilir. NKF KlDOQI klinik pratik kılavuzları GFR’yi tahmin etmek için 24 saat boyunca idrar toplanmasıyla hesaplanan kreatinin kIirensinden ziyade matematik formüllerin kullanılmasını tavsiye eder. Yakın zamanda Sistatin C, böbrek fonksiyonunu tahmin etmek için değerli bir belirteç olarak tarif edilmiştir. Sistatin C, tüm nükleuslu hücreler tarafından üretilen bir sistein proteazıdır. Sistatin C kana salınır ve daha sonra glomerüllerden tamamen filtre olur. Sistatin C cinsiyet, yaş, kronik hastalık (kanser, karaciğer hastalığı) gibi kas kitlesini değiştiren durumlardan etkilenmez ve GFR yi tahmin etmede kreatinine göre daha güvenilir olabilir. Bununla birlikte Sistatin C’nin yaygın kullanımı tam olarak sağlanamamıştır ve böbrek fonksiyonunu belirlemedeki gelecek rolü açık değildir.
Su ve tuz dengesini ve asit baz homeostazını devam ettirmede böbreğin yeteneğini ölçen testler renal tübüler fonksiyonları değerlendirmek için kullanılır. Su kısıtlayıcı test böbreğin idrarı maksimum konsantre edebilme yeteneğini belirler. Üriner konsantrasyon yeteneğinde bozukluğu olan poliürili bir hastada 5 ünite vazapressin uygulanması santral ya da nefrojeııik diabetes insipitusu birbirinden ayırt eder. Santral diabetes insipituslu hastalarda vazapressin uygulanmasıyla üriner ozmolarite ikiye katlanır. Tersine nefrojenik diabetes insipituslu hastalarda üriner konsantrasyonda belirgin bir artış görülmez. İdrardaki çeşitli solidlerin fraksiyone atılımları GFR’ye göreceli olarak solidlerin tübüler tutulumu hakkında yararlı bilgiler sağlar. Fraksiyone sodyum ekskresyonu (atılımı) (FeNa) glomerülde filtre olan sodyumun idrara geçen yüzdesini ifade eder. FeNa’nın belirlenmesi, akut oligürik renal yetmezliğin ayrıcı tanısında çok yararlıdır. Fena spot idrar örneğinden hesaplanabilir. Çünkü pay ve paydadaki hacim terimleri birbi rleri ni iptal eder. %1 den daha az FeNa değeri prerenal yetmezliği (örneğin volüm eksikliği) düşündürür. Oysa % 1’den daha büyük bir değer akut tübüler nekroz veya interstisyel nefrit gibi parankimal renal hastalıklarla uyumludur. Bununla birlikte FeNa’ akut glomerüler hastalık veya radyokontrast madde ilişkili akut renal yetmezlikli hastalarda % 1’ den daha az olabilir. inatçı kusmaları olan hastalarda, hacim açığı yüksek FeNa değerleri ile ilişkili olabilir. Çünkü metabolik alkaloz üriner sodyum atılımını artırır. Bununla birlikte üriner klor konsantrasyonu tipik olarak düşüktür ve hacim açığının doğru bir indeksidir.
İdrarın asidifikasyonu, idrar pH’sının ölçümü ile belirlenebihin önemli bir tübüler işlevdir. Sistemik asidoz varlığında (arteriyal pH<7.3) idrar pH’sl 5.3 ten küçük olmalıdır. Sistemik asidoz varlığında idrarın asidifiye edilmesindeki yetersizlik distal renal tübüler asidozu düşündürür. ormal bir birey günde 150 mg’den daha az protein atar. Glomerüler bazal membran, albümin gibi yüksek moleküler ağırlıklı proteinlerin geçişine karşı etkili bir engel görevi yapar. Renal tübüller filtre olan proteinin küçük bir miktarını yeniden emer. Ateşli hastalığı olan bir bireyde veya şiddetli egzersiz sonrasında proteinüri geçici bir fenomen olarak görülebilir. Postural veya ortostatik proteinüri hastanın yatar pozisyonunda olduğu gece boyunca oluşan idrarda proteinürinin olmaması ile bilinir. Hastaların ayakta olduğu gündüz saatlerinde oluşan idrarda proteinüri tespit edilir, benign bir durumdur. Persistan proteinüri hemen her zaman renal hastalığı işaret eder. Proteinüri 24 saatlik idrarda ya da herhangi bir anda alınan idrarda proteinlkreatinin oranı ile ölçülebilir. Örneğin, idrar protein/kreatinin oranının ıolması, günlük 1 gr proteinüri işaret eder. Yirmidört saatlik idrar toplamadaki zorluklardan dolayı, NKF KI DOQI klinik pratik kılavuzları proteinüri miktarının belirlenmesi için idrar proteinlkreatinin oranının kullanılmasını önermektedir. Günlük 3.5 gr’ den daha fazla protein atılımı olan bireyler glomerüler bir hastalığa sahiptir. Günlük 3.5 gr’ den daha az üriner protein glomerüler ve tübüler hastalıklı bireylerde görülebilir. İdrar analizinde aşikar proteinürisi olmayan fakat diyabet gibi böbrek hastalığı olan bireylerde böbrek hasarının erken belirlenmesi için mikroalbüminüri ölçümü yapılır. Mikroalbüminüri 24 saatte 30- 300 mg albümin atılımı olarak tanımlanır. Mikroalbüminüri renal hastalığın ilerlemesi, diyabet ve hipertansiyonlu hastalarda da kardiyovasküler morbidite ve mortalite artışı ile ilişkilidir.
İdrar analizi, böbrek hastalıklarının tespiti için basit, invaziv olmayan ve ucuz bir incelemedir. Temizce alınmış idrar örneği kimyasal ve mikroskobik yoııar kullanarak hızlı bir şekilde değerlendirilmelidir. Normal idrar rengi koyu sarı ile renksiz arasında değişir. Bu durum ürokrom pigmentinin konsantrasyonuna bağlıdır. Anormal idrar renkleri bir hastalığın bulgusu olabilir veya enfeksiyon, pigment, ilaç yada boya varlığını işaret edebilir. Eritrositlerin veya miyoglobinin varlığı sıklıkla kırmızı veya duman rengi idrar çıkışına neden olur. Bulanık idrar, idrarda yüksek konsantrasyonda lökosit bulunduğunda veya amorf fosfatlar alkali idrarda çöktüklerinde görülür. İdrarın kimyasal değerlendirmesi dipstikle gerçekleştirilir. Dipstik, pH, protein, hemoglobin, glukoz, keton, lökosit esteraz ve nitriti belirleyen, çeşitli kimyasal ajanların emdirildiği bir plastik şerittir. Bu incelemeler semikantitatiftir ve striplerdeki renk değişimleri zemininde derecelendirilir. İdrar proteinini belirleyen dipstik metodu albümine duyarlıdır fakat immunglobulinleri veya tübüler proteinleri (Tamm-Horsfaıı mukoprotein) tespit edemez. Dipstik metodunun dezavantajı, multipl miyelomda sekrete edilen immunglobulin hafif zincirlerinin veya Bence-Jones proteinlerinin tespit edilememesidir. İdrar sülfosalisilik testi, presipitasyon işlemi ile tüm idrar problemlerinin belirlendiği alternatif bir testtir. İleri derecede konsantre idrarda eser ile bir pozitif oranında (10-30 mg/dı) protein görülebilir. İdrarda kan bulguları anormaldir ve geneııikle sağlam eritrositlerin varlığını işaret eder. Dipstik testinin kan için pozitif olmasına rağmen, idrar sedimentinde eritrositlerin görülmemesi, sıklıkla rabdoıniyolizle ilişkili hemoglobinüri ya da miyoglobinürinin bir sonucudur.
Lökosit esteraz ve nitritler geneııikle enfeksiyon varlığında pozitiftir. Bununla birlikte negatif bir test enfeksiyonu dışlamaz. İdrar sedimentinin mikroskobik incelemesi, selüler elementleri, silendirleri, kristalleri ve mikroorganizmaları tespit etmek için kullanılır. Mikroskobik hematüri santrifüj edilmiş idrar örneğinde her büyütme alanında ikiden daha fazla eritrosit bulunması olarak tanımlanır. Glomerüler kökenli eritrositler dismorfik olmaya eğilimlidir, oysa glomerüler olmayan eritrositler benzer boyut ve şekildedir. Piyüri, her büyük büyütme alanında dörtten daha fazla lökosit bulunması olarak tanımlanır. Piyürinin varlığı üriner sistem enfeksiyonu veya enflamasyonunu düşündürür. Steril piyüri (piyüri varlığında idrar kültürünün negatif olması) prostatit, kronik üretrit, renal tüberküloz, renal taş, papiııer nekroz veya interstisyel nefriti akla getirmelidir. İnterstisyel nefrit için daha spesifik bir test Wright ya da Hansel boyamasıyla eozinofilürinin gösterilmesini içerir. Renal tübüler epitel hücreleri belirgin nükleusları olan büyük hücrelerdir ve sıklıkla akut tübüler nekroz, glomerülonefrit veya pyelonefritte görülür. İdrar sedimentindeki epitel hücreleri renal pelvisten üretraya kadar olan üriner sistemin herhangi bir noktasından kaynaklanabilir. EmiImiş lipitleri içeren renal tübüler hücreler oval yağ cisimcikleri olarak adlandırılır. İdrardaki serbest yağ damlacıkları geneııikle ağır proteüniri ile ilişkilidir. Üriner silendirler Tamm-Horsfall proteininin intratübüler presipitasyonundan kaynaklanan silendirik yapılardır. Silendirierde eritrosit veya lökosit varlığı olası bir inflamatuar parankimal renal hastalık için delil sağlar. Eritrosit silendirieri sıklıkla proliferatif glomerüler lezyon varlığını işaret eder fakat akut interstisyel nefritli hastalarda da görülebilir. Akut böbrek yetmezlikli bir hastada tübüler hücre silendirlerinin varlığı akut tübüler nekroz teşhisini doğrular. Üriner sistem enfeksiyonlu bir hastada lökosit silendirierinin varlığı alt üriner sistem enfeksiyonundan ziyade pyelonefrit teşhisini gösterir. Lökosit silendirleri interstisyel nefritli hastalarda ve daha az olarak glomerülonefritli hastalarda da görülebilir. Spesifik semptomların yokluğunda asidik idrarda tespit edilen kalsiyum oksalat (zarf şeklinde) ve ürik asit (eşkenar dörtgen şeklinde) kristallerinin çok az klinik önemi vardır. İdrarda sistin kristallerinin (benzen halkası şeklinde) varlığı nadir bir hastalık olan sistinüriyi işaret eder. Üçlü fosfat kristalleri (tabut kapağı şeklinde) alkali idrarda belirlenebilir. Santrifüj edilmemiş idrar örneğinde bakterinin varlığı önemlidir ve muhtemel üriner sistem enfeksiyonu varlığı için delil teşkil eder.
Böbrek hastalığı olan bir hasta renal hasarın tipi ve belirtileri temelinde farklı klinik sendromlara sınıflandırılabilir. Akut nefritik sendrom; idrar sedimentinde eritrosit silendirleri ve dismorfik eritrositlerin gösterildiği, glomerüler kökeni destekleyen değişen derecelerde proteinüri varlığının eşlik ettiği, göreceli olarak ani başlangıçlı böbrek yetersizliği ile karakterize klinik bir sendromdur. Akut nefritik sendromda sodyum açığı azalmış GFR’de beklendiğinden dikkate değer bir şekilde daha yüksektir. Plazma albümini genellikle normaldir. Sonuç olarak tutulan sodyumun belirgin bir kısmı damar içinde kalır ve hipertansiyon, plazma hacmi dilüsyonu, dolaşımsal yüklenme ve konjestif kalp yetmezliğinin varlığını açıklayabilir. Akut poststreptokokal glomerülonefrit akut nefritik sendrom için prototip olmasına rağmen diğer enfeksiyonlarda bu sendroma neden olabilir. Akut nefritik sendrom mezengioproliferatif glomerülonefrit nefrit gibi primer glomerüler hastalıklar ve sistemik lupus eritematozus, Henoch-Schönlein purpurası ve esansiyel miks kryoglobulinemi gibi birçok sistemi tutan hastalıklar tarafından da oluşturulabilir. Nefrotik sendrom, 3.5 gr/gün/1.73m2’den daha fazla proteinüri ile kendisini gösteren artmış glomerüler geçirgenlikle karakterizedir. Ödem, hipoalbüminemi ve hiperlipidemi mevcuttur. Nefrotik sendromlu hastalar proteinüriye ek olarak oval yağ cisimcikleri, glomerüler silendirler ve nadir hücresel elementler gösterebilirler. Fakat dismorfik eritrosit ve eritrosit silendirieriyle karakterize aktif idrar sedimenti yoktur. Ayrıcı tanı minimal değişiklik hastalığı, membranöz nefropati, fokal segmental glemerüloskleroz, diyabetik nefropati ve amiloidoz gibi glomerüler hastalıkları içerir. Karmaşık klinik tablo (nefrotik/nefritik sendrom) varlığında membran-proliferatif glomerülonefrit SLE, postenfeksiyoz glomerülonefrit ve miks kryoglobulinemi en olası teşhislerdir.
Hızlı ilerleyen renal yetmezlik terimi böbrek fonksiyonunun % 50’sinden daha fazlasının haftalar ya da aylar içinde kaybolduğu hastalar için kullanılır. Bu durum, böbrek fonksiyonunda ani bir azalmanın olduğu akut böbrek yetmezlikli hastalar ve böbrek fonksiyonlarının aylar veya yıllar içinde azaldığı kronik böbrek yetmezlikli hastalarınkine zıttır. Hızlı ilerleyen böbrek yetmezliliği ile başvuran bir hastanın ayırıcı tanısı gösterilmiştir. Hızlı ilerleyen böbrek yetmezliğinin önemli fakat seyrek nedenlerinden birisi hızlı ilerleyen glomerülonefrittir. Bu durum, renal biyopside temel histolojik bulgu olarak yoğun glomerüler kresentlerin görüldüğü klinik bir sendromdur. Dismorfik eritrositler, eritrosit silendirieri ve orta dereceli proteinüri hızlı ilerleyen glomerülonefritte karakteristiktir. Akut böbrek yetmezliği, günler ve birkaç hafta içinde böbrek bozukluğuna yol açacak şekilde böbrek fonksiyonlardaki azalmaya neden olan bir sendromdur. Akut böbrek yetmezliği, böbrek kan akımmdaki bir azalma (prerenal azotemi), intrensek parankimal hastalık (intrarenal azotemi), idrar akımında obstrüksiyon (postrenal azotemi) neticesinde oluşabilir. Akut böbrek yetmezliğinin değerlendirilmesindeki genel yaklaşım anlatılmıştır. Tubülointerstisyel nefrapati, başlıca renal tübülleri ve interstisyumu etkileyen, glomerüllerin ve böbreğin damarsal yapısının göreceli olarak korunduğu bir grup klinik hastalık için kullanılır. Hastaların çoğunda böbreğin işlev bozukluğunun ilerleme hızına göre akut veya kronik interstisyel nefrit şeklinde sınıflandırılabilir. Kronik tubülointerstisyel nefropati; renal yetersizlik, nefrotik olmayan düzeyde proteinüri, böbrek bozukluğunun derecesine uyumlu olmayacak şekilde ciddi tübüler hasar ile karakterizedir. Böylece kronik tubülointerstisyel hastalığı olan hastalar, sıklıkla orta dereceli sodyum kaybı, hiperkalemi, böbreğin işlev bozukluğu ve orta dereceli olduğu zaman bile normal anyon açıklı metabolik asidoza sahiptirler. Akut interstisyel nefrit (sıklıkla bir ilaç tarafından oluşturulur) renal interstisyumda belirgin enflamatuar hücre infiltrasyonunun olduğu, ani başlangıçlı böbreğin işlev bozukluğu ile karakterizedir ve akut böbrek yetmezlikli hastaların ayırıcı tanısında önemlidir.
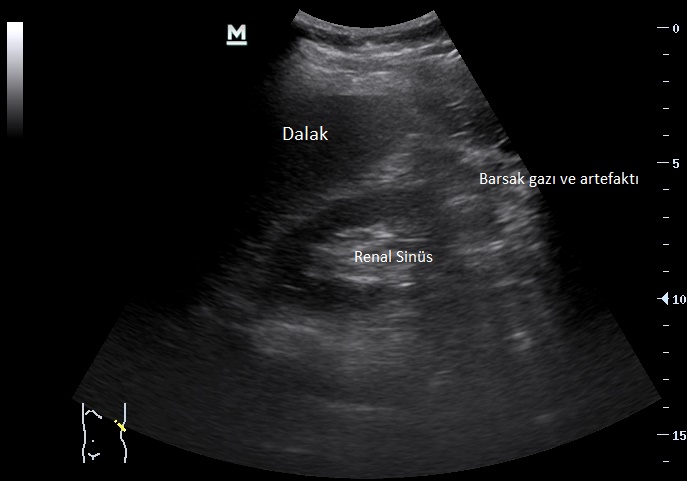
Üriner sistemin en yaygın görüntülerne çalışmalarından biri böbrek ultrasonografisidir. Böbrek ultrasonografisi, böbrek ve toplayıcı sistemin anatomik görünümün elde edildiği invaziv olmayan bir metottur. Bu teknik; özellikle böbrek boyutlarının belirlenmesi, renal kitlelerin tespiti, toplayıcı sistemin genişlemesi ve hidronefrozun belirlenmesinde yararlıdır. Sonogramda hidronefrozun yokluğu, obstrüktif üropatiyi dışlamaz (özelliklede akut obstrüksiyon, volüm kaybı veya retroperitoneal fibrozis varlığında). ilerlemiş böbrek yetmezliği olan bir hastada 8 cm’den daha küçük böbreklerin bilateralolarak varlığı kronik geri dönüşümsüz bir olayı işaret eder. Oysa 11-13cm’lik normal boyutlu böbreklerin varlığı akut böbrek yetmezliği veya diyabet, amiloidoz ya da multipI miyelom gibi hastalıkların neden olduğu kronik böbrek yetmezliğini düşündürür. B mode ultrasonografinin doppler görüntülerne ile kombine olduğu dubleks ultrasonografi, majör renal arter ve venIerin hastalıklarını belirlemede yardımcı olur. Ultrasonografi kolaylıkla basit kistleri belirleyebilir. Bununla birlikte kompleks kistler veya solid lezyonlar bilgisayarlı tomografi veya manyetik rezonans görüntülerne ile ileri incelemeye gerek duyar. Böbrek boyutlarında 2 cm’ den daha fazla farklılık renovasküler hastalığı, böbreğin skarlaştığı reflü nefropatisini veya
konjenital anormallikleri düşündürür. Ultrasonografi böbrek biyopsisinde kılavuzluk etmek, nefrostomi tüplerinin yerleştirilmesini sağlamak, böbrek etrafındaki mayi birikimini boşaltma işlemi sırasında da kullanılır.
iVP, glomerüler filtrasyonla böbreklerden atılan iyodinize radyografik kontrast ilaçların intravenöz uygulanmasını anlatır. Kontrast ilaç renal tübüllerde konsantre olur ve enjeksiyonun ilk birkaç dakikası içinde nefrogram görüntüsünü oluşturur. Kontrast ilaç ilerledikçe toplayıcı sistem, kaliksler, renal pelvis, üreterler ve mesane görüntülenir. ivp kullanımı, anatomik yapıların daha detaylı görüntülenmesi gerektiğinde veya obstrüksiyon ve akut nefrolitiazisin değerlendirilmesinde gereklidir. iVP’nin dezavantajı, GFR’si 60 ml/dk/l.73 m2, den daha az olan böbrek yetmezlikli hastalarda, volüm eksikliğinde, diyabet veya konjestif kalp yetmezliğinde nefrotoksisiteyi başlatabilen radyokontrast madde kullanımını gerektirmesidir. Retrograd pyelografi, sistoskopi yapılırken üreterlerin içine doğrudan radyokontrast madde enjeksiyonuyla gerçekleştirilir. Bu teknik özellikle iVP’de böbreklerin görüntülenemediği durumlarda, üreter veya renal peIvisteki tıkayıcı lezyonların tanınmasında yardımcıdır. Üreterik taşlar, özel bir basket kullanılarak bu işlem sırasında yerinden çıkartılabilir. Böbreğin bilgisayarlı tomografisi genellikle kontrast ilaç verilerek yapılır. Renal taşların ve hemorajinin araştırılması bu duruma bir istisna teşkil eder. Bilgisayarlı tomografi renal kitleler, kompleks kistler, perinefrik ve renal ven trombozu gibi vasküler patolojik durumların değerlendirilmesinde çok yararlıdır. Seçilmiş vakalarda perinefritik abse gibi sıvı koleksiyonun boşaltılmasına ya da böbrek biyopsisine kılavuzluk etmek için kullanılır. Üriner sistemin diğer görüntülerne çalışmalarında olduğu gibi bilgisayarlı tomografi de de sıklıkla radyokontrast ajanlar kullanır ve böbrek fonksiyonu bozuk olan hastalarda kontrendikedir.
Manyetik rezonans görüntülernede, yüksek manyetik alanlar ve görüntüleri oluşturmak için radyo frekansları kullanır. Manyetik rezonans görüntülerne, kompleks renal kitlelerin tanımlanmasında, renal tümörlerin evrelendirilmesinde, renal ven invazyonunun tespitinde ve renovasküler hastalığın teşhisinde en yararlıdır. Manyetik rezonans anjiyografıdeki teknik ilerlemeler, renal arter darlığının tespit edilme sıklığını artırmıştır ve aynı zamanda hastalığın boyutunu da ortaya koyabilir. Manyetik rezonans görüntüleme, pacemaker gibi implante edilmiş ferromanyetik cihazları olan hastalarda kontrendikedir. Radyonüklid görüntülerne, böbrekler hakkında önemli invaziv olmayan bilgi sağlar. Test radyoaktif bileşiklerin intravenöz uygulanmasını içerir. Daha sonra bir gama kamerayla görüntüler alınır. Gebelik renal radyonüklid görüntülerne için tek kontrendikasyondur. Renal arıeriyograji, aorta ve renal arterlere radyografik kontrast ilacın doğrudan enjeksiyonunu içerir ve böbreğin damarsal yapısının değerlendirilmesinde kullanılır. Renal arter darlığı veya trombozu şüphe edilen hastalarda ve renal kitlesi olan hastaları değerlendirmede özellikle faydalıdır. Açıklanamayan hematürisi olan hastalarda ya da vasküler malformasyon şüphesi olanlarda renal arteriyogram yapılmalıdır. Poliarteritis nodosalı bireyler mikro anevrizmaların tespit edilebilmesi için, seçici renal arteriyograma ihtiyaç duyabilirler. Renal ven kateterizasyonu, renal ven trombozu teşhisini doğrulamak için veya renal venden kan örnekleri almak için kullanılır.
Bilgisayarlı tomografi veya manyetik rezonans görüntülerne renal ven trombozu teşhisini doğrulamak için kullanılmasına rağmen, teşhisin şüpheli olduğu durumda ya da tanısal şüphenin yüksek olduğu durumlarda renal venografi gerekebilir. Böbrek biyopsilerinin çoğu glomerüler bir lezyondan şüphe edildiğinde ve daha az olarak açıklanamayan akut böbrek yetmezlikli hastalarda yapılır. Perkütan biyopsi, en yaygın kullanılan tekniktir ve göreceli olarak güvenlidir. Kapalı böbrek biyopsinin potansiyel komplikasyonları; hematüri, renal hematom, arteriyovenöz fistül gelişimi ile vasküler laserasyon ve karaciğer, dalak veya bağırsağın uygun olmayan biyopsisini içine alır. Perkütanöz böbrek biyopsisi tek böbrek varlığında, ektopik böbrekte, at nalı böbrek, kontrolsüz kanama bozuklukları, kontrolsüz hipertansiyon, renal enfeksiyon, renal neoplazm durumlarında ve uyumu olmayan hastalarda kontrendikedir.
Böbrek hastalıklarının erken tespiti belirgin böbrek bozukluğu oluştuktan sonra yükselen serum parametrelerinde değişiklik olmadan önce belirlenebilmesine ihtiyaç duymaktadır. Üriner biyomarkerlerin kullanımı böbrek hastalığı için risk taşıyan bireyleri belirlemeye yardım edecek olan tanısal araçlar olarak önem kazanmaktadır. Bubiyomarkerler böbrek yetmezliğinin gelişimini önleyen veya böbrek fonksiyonunun hızlı bozulmasını sınırlayan yeni tedavi yaklaşımların gelişimine izin verecektir. Ek olarak, böbrek hastalıklı bireylerin genetik analizleri ilerleyid böbrek hastalığı riskini azaltan tedavi uygulamalarına olanak sağlayacaktır.
Normal şartlar altında çok değişken sıvı alımına rağmen, hücre içinde ve vücudun sıvı kompartmanlarındaki sıvı ve elektrolit içeriği sabittir. Bu denge; hücreler boyunca sıvı ve solütün yer değiştirmesi ve böbreklerin vücudun alım ile ihtiyacını dengelemek için idrada su, elektrolit ve solüt atımını ayarlama yeteneği ile sağlanır. Sağlıklı bireylerde vücut sıvılarındaki solüt miktarı 285 ile 295 mOsm/kg su arsında tutulur. Vücut su ve solüt konsantrasyonlannın sıkı regülasyonu, böbreğin 24 saatlik idrar miktarını 500 ml ile 24 L arasında değiştirebilme yeteneği ile mümkün olmaktadır. Böbreğin kendi fonksiyonlarını sürdürebilme yeteneği yapısıyla susama-nörohipofiz-renal yola bağlıdır. İnsanda toplam vücut ağırlığının %60’ını su oluşturur. Toplam vücut suyu ile yaşa, cinsiyete ve beslenme durumuna göre değişen vücut yağ miktarı ile ters orantılıdır. Toplam vücut suyunun yaklaşık üçte ikisi hücre içi bölümdedir. Hücre dışı suyun dörtte üçü interstisyel alanda, dörtte biri ise plazmadadır. Potasyum ve magnezyum hücre içi alanın majör katyonlarını, sodyum ise hücre dışı alanın majör katyonunu oluşturur. Fosfat ve protein hücre içi alandaki majör anyonlar iken, klor ve bikarbonat hücre dışı alanın majör anyonlarıdır. Hücre zarı, hücre içi ve hücre dışı sıvı alanlan arasında bariyer görevi yapar. Zarlar göreceli olarak suya geçirgen olduklarından ozmotik gradyent hücre zarı boyunca sıvı geçişini belirler. Bu yüzden geçici değişiklikler dışında, hücre içi ve hücre dışı sıvı alanlan ozmotik denge içindedir. Sıvının damar ve interstisyel alanlar arasındaki transferi kapiller duvar boyunca olur ve bu hidrostatik basınç farkı ile plazma onkotik basınç arasındaki Starling Eşitliği ile ilgili denge ile sağlanır.
Böbrek, hücre dışı sıvı (HDS) volümünün sabit kalmasında en önemli rolü oynar. Hücre dışı sıvıdaki azalmaya cevap, eksternal sodyum ve su dengesini düzenleyen primer renal cevabın yanı sıra kan basıncını sürdürmek için kardiyak outputu ve periferal vasküler direnci ayarlayan hemodinamik cevaplardan oluşur. Bu iki cevaba entegre va/üm cevabı denir. Hemodinamik değişiklikler, volüm azalması durumunda dakikalar içinde gelişir ve taşikardi, arteriyel vazokonstriksiyona bağlı artmış periferik direnç, venokonstrüksiyona bağlı azalmış venöz kapasitans ile karakterizedir. Böbreğin su ve tuz tutulumu 12-24 saat içinde gerçekleşir ve birçok hormon salınmasını içerir. Ekstrarenal baroreseptörlerin uyarılması, böbreklerde su tutulumunu sağlayan ADH salınmasına sebep olur. Vasküler endotel hücreler tarafından üretilip salınan endotelin gibi vazokonstrüktif faktörler sistemik hemodinaminin sağlanmasında roloynar. Efferent arteriolar direncin artması, filtrasyon fraksiyonunu, peritübüler protein konsantrasyonunu, proksimal tübüllerdeki su ve sodyum emilimini arttırır. PGE2 gibi vazodilatatör prostaglandinler, vazokonstrüktif etkileri ayarlar ve hücre dışı sıvı volümünde ki düşüşle birlikte olan durumlarda renal kan akımını arttırarak GFR’yi sabit tutarlar. Bu etki, NSAİİ’lerin volüm azalması durumunda niçin tehlikeli olduğunu açıklar.
Entegre volüm cevabı, efektif dolaşan volümdeki (EDV) değişiklikleri algılayan afferent mekanizmalara bağlıdır. EDV’yi tanımlamak zordur, çünkü ölçülemez ve vücudun farklı sıvı bölmelerindedir. EDV, arteryel dolaşım içinde doluluk ve gerilim ile alakalıdır. Total sıvı volümünün sadece %i5’ i arteryel alanda olduğundan, arterlerin taşıma kapasitesine bağlı olarak arteryel kan volümü azalabilir. çoğu durumlarda EDV, ekstrasellüler sıvı artışının varlığında azalmış EDV olan bazı hastalıklar dışında (kalp yetmezliği gibi), total ESS volümü ile orantılıdır. Bu hastalıklarda EDV ya azalmış kardiyak output ya da arteryel vazodilatasyon sonucu olarak azalır ki, bu da arteryel dolaşımdaki doluluğu ve gerilimi azaltır. Afferent algılayıcılar, EDV’ye toplam ESS volümünden daha çok tepki verdikleri için EDV’nin düşük olduğu konjestif kalp yetmezliği ve hepatik siroz gibi hastalıklarda entegre volüm tepkisinde devamlı aktivasyon olur, bu da daha çok tuz ve su geri tutulumunu provoke eder.
Sodyum dengesindeki değişiklikler hücre dışı volümde bozukluklara yol açar. Gerçek volüm azalmasına sebep olan nedenler (hem efektif dolaşan volüm hem de hücre dışı volüm azalmıştır) listelenmiştir. Volüm azalmasının en sık sebebi ekstra renal kayıplardır ve bu böbrek fonksiyonları normal iken olduğunda, idrar oldukça konsantre, tuzdan fakir ve asidik olur. Eğer volüm azalması renal kayıplar nedeni ile olursa, idrar uygunsuz şekilde dilüedir ve bazen tuzdan zengindir. Nefrojenik diabetes insipitus sendromu nedenlerden biridir ve sendromun konjenital mutasyonla Y2 vazopressin reseptöründe fonksiyon kaybı (X’e bağlı) oluşur, bunun yanısıra otozomal dominant ve otozomal resesif formlarında mutasyon sonucu toplayıcı kanaldaki aquaporin-2 kanallarının inaktive olmasına sebep olur. Gerçek volüm azalmasındaki klinik bulgular, arteryel yatağın tam dolamamasına sekonderdir ve tam dolmamaya (underfilling) verilen hemodinamik ve renal cevaplara bağlı oluşur. Hafif düzeyde volüm azalması, ortostatik baş dönmesi ve taşikardiyle birlikte olabilir. Hücre içi volüm daha fazla azaldıkça istirahatta taşikardi belirginleşir ve idrar çıkışı azalır. Ciddi volüm eksikliği olan hastalarda, vazokonstrüksiyon, hipotansiyon, mental değişiklikler, soğuk ekstremiteler, ihmal edilebilir düzeyde idrar çıkışı gözlemlenebilir. Bu klinik tablonun çoğu hipovolemiye cevap olarak salınan katekolaminler ve angiotensin II gibi vazokonstrüktör hormon ların etki leriyle açıklanabilir. Önemli düzeyde volüm azalması, klasik klinik bulgular olmadan da oluşabilir. Kardiyovasküler ilaç kuııananlarda ve diüretik nedeniyle veya intrensek renal hastalık nedeniyle böbrekten fazla sodyum kaybeden hastalarda volüm azlığını ve klinik durumlarını hidrasyon düzeyini değerlendirmek zor olabilir. Uygun klinik öykü, hastanın önceki kilosunun bilinmesi daima zorunlu ve önemlidir. Eğer hidrasyon düzeyi ile ilgili şüphe varsa, özellikle durumu kritik hastalarda, sağ kalp kateterizasyonu vasıtasıyla pulmoner kapiııer wedge basıncı ölçmek, intravasküler volüm düzeyini değerlendirilmesini sağlar. Yerine konacak sıvının kesin miktarı ve hızı volümde ki azalmanın şiddetine bağlıdır ki, bu da klinik bulgularla tahmin edilebilir. Eğer sıvı açığı parenteral yol ile yerine konulacaksa verilecek sıvının dağılımı dikkate alınmalıdır. %0.9 sodyum klorür ve koııoid içeren sıvılarda neredeyse tüm volüm hücre dışı bölgede kalır ve bu nedenle hipovolemiyi düzeltmede parenteral solüsyon olarak tercih edilirler. Buna karşın %5 glikozun sadece 1/3’ ü tıücre dışı alanda kalır.
Su ve tuz alımı renal ve ekstra renal kayıpları aşarsa volüm artışı olur.Altta yatan neden genellikle böbrek tarafından su ve sodyum tutulumudur. Su ve sodyum tutulumu EDV’deki artma sonucu olarak primer veya EDV’deki azalmaya bağlı olarak sekonder olabilir. Renal sodyum ve su tutulumunun net sonucu, kapiller hidrostatik basınçta artışa ve sıvının intravasküler alandan intertisyel alana geçmesine yol açan Starling kuvvetlerindeki değişikliktir. Pek çok nefrotik sendromlu hastada primer renal sodyum tutulumunun sonucu olarak EDV de artış vardır. İlerlemiş karaciğer hastalığında EDV, vazodilatasyon nedeniyle arteryel dolum azlığı yüzünden azalmıştır. EDV azalır bu da sekonder böbrek sodyum tutulumuna neden olur. Bununla birlikte karaciğer hastalığının erken safhalarında, volüm fazlalığı primer böbrek sodyum tutulumundan
kaynaklanabilir. Karaciğer hastalığı, nefrotik sendrom ve ileri düzey malnütrisyonla birlikte olan ciddi hipoalbüminemi lokal kapiller homeostatik mekanizmayı bozabilir ve ödem oluşumuna yol açabilir. Volüm fazlalığını tedavi etmede esas yöntem diüretik verme ve aynı zamanda diyette sodyum kısıtlamadır. Diüretikler, sodyumun nefronun değişik bölgelerinde geri emilimini önleyerek natriürezisi arttırırlar, Proksimal tübüllere etki eden diüretiğin başlıca örneği, sodyum bikarbonatın proksimal geri emilimini bloke eden karbonik anhidraz inhibitörü olan asetazolamiddir. Bu nedenle uzun süreli asetozolamid kullanımı hiperkloremik asidoza yol açabilir. Tiazid benzeri diüretiklerin bir üyesi olan metazolon, distal tübülde sodyum geri emilimini bloke etmesinin yanı sıra kendiside proksimal tübülde natriüretik etki gösterir. Proksimal tübül fosforun geri emilim yeri olması sebebiyle metazolon kullanımına ağır fosfatüri eşlik edebilir. Furosemid, bumetanid gibi loop diüretikleri, Henle kulpunun çıkan kalın kolunda sodyum, klor ve potasyumun ko-transportunu inhibe ederler. Tiazid diüretikler, distal tübüldeki sodyum ve klor kotransportunu inhibe ederler. Loop diüretikleri kalsiyum atılımını arttırırken, tiazid diüretikleri kalsiyum atılımını azaltırlar. Bu nedenle loop diüretikler hiperkalsemi tedavisinde, tiazid diüretikleri kalsiyum taşı oluşumunu önlemede yararlıdır.
Bir aldosteron antagonisti olan spironolakton, kortikal toplayıcı kanaldan sodyum geri emilimini azaltır. Amilorid gibi primer sodyum kanal blokerleri, aldesterondan bağımsız mekanizma ile kortikal toplayıcı kanallarda sodyum geri emilimini önler. Bu son iki grup diüretik birçok diüretik kullanımıyla birlikte komplikasyon olarak görülen hipokalemiye sebep olmaz. Kalp yetmezliği ve nefrotik sendrom gibi ileri düzeyde sodyum tutulumunun ve ödemin olduğu durumlarda nefronun farklı bölümlerine etkili diüretik kombinasyonu, tek sınıf diüretik kullanımından daha etkilidir. Bundan başka, potasyum tutan diüretikler ile potasyum kaybettiren diüretiklerin birlikte kullanımı potasyum ve magnezyum eksikliğini en aza indirebilir. Sirozlu ve asitli hastalarda, kolloidal ajan infüzyonu ile eş zamanlı parasentez yapılması diüretik kullanımına karşı iyi bir terapötik alternatiftir.
Ozmolalite, katı partiküllerin (solütlerin) oranının tüm sıvı kompartmanlarındaki suya oranıdır ve çok dar bir sınırda tutulur. Su birçok hücre zarından serbestçe geçtiğinden, hücre dışı sıvı ozmolalitesinde ki değişiklik, hücre içi volümde de resiprokal değişiklik yapar. Hücre dışı sıvı ozmolalitesi, bu bölümde majör solütler üzerinden serum osmolalitesi hesaplanarak tahmin edilebilir.Bununla birlikte, etanol, metanol, etilenglikol gibi aktif maddelerin varlığında, ölçülen osmolalite hesaplanandan fazladır. Bu gibi durumlarda ozmolar gap (ölçülen-hesaplanan osmolalite) toksin varlığı konusunda ipucu verir ve bu maddelerin konsantrasyonlarını tahmin edebiliriz. Plazma sodyum konsantrasyonunda ki artış hemen hemen daima su dengesindeki değişikliği yansıtır. Çünkü sodyum hücre dışı sıvıdaki majör katyondur, ozmolaliteye ait bozukluklar hücre dışı sıvıdaki anormal sodyum konsantrasyonunu doğrudan gösterir. Ozmolalitenin ayarlanması, böbrekten su atılımındaki değişikliklerle düzenlenir ve EDV’de azalma olmadıkça böbrek sodyum atılımı ozmoregülatör faktörlerden etkilenmez. Hücre dışı sıvı ozmolalitesi, su dolum reaksiyonunda ki (water repletion reaction) iki yolla ayarlanır. Santral sinir sisteminde 3. ventrikül duvarında yerleşen ozmoreseptör hücreler, internal karotid dolaşımdaki kanın ozmolalitesinde ki minör değişiklikleri algılar. Ozmoreseptörlerdeki nöral sinyaller, arka hipofiz bezinden ADH salınımını ve kendiliğinden susuzluk hissini uyarıro ADH, böbrek toplayıcı kanallarının suya olan geçirgenliğini ve su geri emilimini arttırarak su tutulumuna sebep olur. Susuzluk su alımında artışa yol açar. Hücre dışı volümü yaklaşık % 50 azaldığında, su tutulumu ozmolaliteye bakılmaksızın, ESS volümü yeniden dolma yoluyla sağlanır. Bu durumda arteryel ve venöz dolaşımdaki baroreseptörler, doğrudan nöral yollar aracılığıyla ADH salınımını uyarır. Bu durumda ozmoreseptörlerin fonksiyonu olmadan nonozmotik uyarı sodile ADH salınır. Su tutulumu ters düzenleme mekanizması ile su dolumunu aktive eder. Susuzluk hissinin baskılanması ve ADH salınmasının inhibisyonu, su alınması baskılar ve böbrek su atılımında artışa yol açar
Hiponatremi sebepleri normal, yüksek ve düşük total vücut sodyum içeriğiyle görülür. Bazı hiponatremik hastalıklarda serum osmolalitesi yüksektir, bu yüzden hücre içi su miktarı artmaz ve beyin ödemi riski yoktur. Hiperglisemi ve hipertonik mannitol kullanımında, su hücre içi bölgeden hücre dışı bölgeye kaydığından hiponatremiye sebep olur. ileri düzeyde hiperlipidemisi ve hiperproteinemisi olanlarda normal serum osmolalitesiyle birlikte hiponatremi görülebilir ve bu serum elektrolit konsantrasyonunu ölçmek için kullanılan yanlış metodolojik teknikten kaynaklanır. Bu elektrolitlerin ölçümü için iyon seçici elektrolit kullanımının artışı psödohiponatremin bu sebeplerini azaltmıştır. Hiponatremi, transüretral prostat rezeksiyonu veya histeroskopik tetkik yapılan hastalarda, yıkama solüsyonu olarak kullanılan hipoozmolar solüsyonlar olan glisin veya sorbitolun büyük miktarda emilmesi sonucu görülür. Pek çok hiponatremik hastalık hipoozmolalite ile birlikte görülür. Esas itibarıyla fazla su tüketimi ve/veya böbreklerden az su atılımı hipoozmolaliteye sebep olur. Normal şartlar altında böbrekler günde 16-20 litre solütten fakir su veya serbest su atabilir. Azalmış GFR ve EDV, distal nefronda böbrek dilüsyon segmentinde sodyum klor geri emiliminin bozulması, hipotonisiteye cevap olarak salınan ADH baskılanmasında yetersizliğine (uygunsuz ADH sendromu) sekonder olarak böbreklerden su atılımı bozulabilir. Ender bir konjenital sendrom olan uygunsuz antidiürez sendromunda, V2 vazopressin reseptörlerinde mutasyonla fonksiyon kazanımı vardır, böylece vazopressin yokluğunda bile reseptör aktive olur. Böbreklerin serbest su atım kapasitesi yüksek olduğundan, primer polidipsili hastalarda hem çok aşırı su alımı hem de su atılımında bozulma hiponatremiye sebep olur. Azalmış GFR de veya solüt alımında azalmada da çok fazla su alımı olmasa da hiponatremi görülebilir. Azalmış GFR’li hastalarda, filtratın distal nefrona ulaşımı azaldığından su atılımı bozulur. Kronik açlıkta ve bira alkoliklerinde oral besin alımı azalmıştır. Böbrek su atılımı ozmolar alıma bağlı olduğundan, bu hastalarda orta düzeyde sıvı alımında hiponatremi gelişebilir.
Daha yaygın olarak, böbreğin dilüe edici segmentlerinde tuz emilim oranının azalması yüzünden idrarı maksimal dilüe etme yeteneğinin bozulması, ADH’nın nonozmotik salınımının sürekli olması veya bunların ikisinin birlikteliğinde hiponatremi oluşur. EDV’nin azaldığı hastalıklarda non-ozmotik ADH salınımı olur ve bu da böbrekler tarafından su tutulumuna neden olur. Ek olarak bu hastalarda proksimal sodyum klor geri emilimi artar böylece sodyum klorürün distal segmente ulaşımı azalır. Bu hastalıklar volüm fazlalığı veya azlığının belirtileri ile birlikte olabilir. Uygunsuz ADH salınım sendromu (UADHS), ADH veya ADH benzeri maddelerin primer salındığı sendromun protipidir. çoğu zaman santral sinir sistemi veya pulmoner sistem patolojileri ile birlikte oluşur. Pek çok ilaç ADH salınımını veya etkisini arttırır. Dolaşırnda ki ADH toplayıcı kanaldan fazla miktarda su emilimine ve orta düzeyde hücre dışı sıvı artışına sebep olur. Yolüm artışı ile birlikte renal perfüzyon da artar ve sonrası böbrekler tekrar övolemiyi sağlamak için sodyum geri emilimini azaltır. Yakın zamanda vazopressin düzeyleri baskılanmış belirgin uygunsuz ADH sendromlu ki infant tanımlanmıştır. Değerlendirmede, bu hastaların Y2 vazopressin reseptörlerinde mutasyonla işlev kazanması saptanmıştır.
Hiponatreminin bulguları hipoozmolar hücre dışı ortamdan beyin hücrelerine su geçişinin artması ve bunun sebep olduğu beyin hücrelerinin şişmesine bağlıdır. Bu yüzden herhangi bir hastada akut mental fonksiyonlardaki değişiklik hiponatremiyi akla getirmelidir. Hiponatremik hastalara yaklaşımda, fizik muayene ile volüm durumunu değerlendirmek en önemli basamaktır. Hiponatremik hastalarda ayırıcı tanıda en zor kısım EDY’si azalmış hastalarla UADHS olan hastaları ayırt etmektir. İki durumda da serum ozmolalitesine göre idrar ozmolalitesi uygunsuz biçimde daha konsantredir. Azalmış EDY’de idrar sodyum konsantrasyonu ihmal edilebilir, oysaki UADHS’da 30mEg/L’nin üstündedir. Azalmış EDY’de BUN ve ürik asit düzeyleri yüksektir. Eğer hiponatremi düşük BUN ve ürik asit düzeyleri ile birlikteyse tanıda UADHS daha çok düşünülür. Hiponatremide dikkate alınması gereken temel veriler; vücut ağırlığı, serum elektrolitleri, serum ozmolalitesi, idrar elektrolitleri, idrar ozmolalitesidir. Hiponatremi tedavisi sırasında serum ve idrar elektrolitleri sıklıkla ölçülmeli, hastanın aldığı ve çıkardığı takip edilmelidir. Genel bir kuralolarak idrardaki sodyumdan daha fazla tonisiteli sodyum solüsyonları verilirse serum sodyum konsantrasyonları artar. Tedavi altta yatan klinik hastalığa ve hastanın volüm durumuna göre ayarlanmalıdır. Volüm fazlalığı olan hastada su ve tuz alımı kısıtlanmalıdır. Azalmış EDY’si olan ve ekstrarenal kayıplara sekonder gerçek hipovolemisi olanlarda, tedavide izotonik sodyum klorür içeren solüsyonlar verilmelidir. UADHS’da su kısıtlaması tedavinin esasını oluşturur. Bununla birlikte, ABD’ nin güney bölgelerinde hastalarda susuzluk hissi sürekli olduğundan bunu sağlamak zordur. Demetilklortetrasiklin ve lityum öneriise de, çok kabul edilir bir tedavi şekli değildir. Özellikle UADHS hastalarında hipertonik tuz verilmesi derin natriürez yapar ve kısa zamanda hiponatremi gelişir. Tedavide en çok kabul gören yaklaşım norınal tuz ile birlikte furosemidin kombine kullanımıdır. ormal tuz konsantrasyonu hiponatremiyi düzeltirken furosemid normal tuzun yarısının idrarda atılımını arttırır.
Hiponatremi aniden gelişirse 48 saat serebral ödeme sebep olabilir. Tipik bulgu ve semptomlar, baş ağrısı, bulantı, kusma, halsizlik, kooperasyonun azalması, deIiryum ve nöbetlerdir. Günler veya haftalar içerisinde hiponatremi gelişen hastalarda nörolojik bulgular ve semptomlar daha silik görülebilir. Serum sodyumunu düzeltme hızı, semptomlara ve hiponatreminin süresine bağlıdır. Akut hiponatremide, santral sinir sistemi bulguları ve nöbetler yatışıncaya kadar serum sodyum seviyesi hızlı düzeltilebilir (2,5 mEq/Llsaat). Ancak bundan sonra serum sodyum düzeyindeki değişikliğin 20mEq/Llgünü geçmesinden sakınmak gerekir. Kronik hiponatremjde (>48 saat) serum sodyum konsantrasyonu 20mEq/L’ye ulaşıncaya kadar saatte 0,5mEq/L oranında düzeltilmelidir. İster akut ister kronik olsun asemptomatik hiponatremik hastalarda agresif tedaviye ihtiyaç yoktur. Çok hızlı düzeltmelerde santral pontin miyelinolizis oluşumu yüzünden dikkatli olunmalıdır. Siroz, konjestif kalp yetmezliği, renal yetmezliğe sekonder gelişen hipervolemik hipotonik hiponatremide, altta yatan nedenin tedavisi yanında aynı zamanda hipotonik idrar atılımını kolaylaştıran loop diüretiklerinin kullanılması gerekir. Sıvı kısıtlaması 24 saatte bir litrenin altında olmalıdır. Altta yatan nedenin tedavisine cevap vermeyen kronik UADHS lu hastalarda tek başına su kısıtlaması çoğu zaman tedavi için yeterlidir. Dirençli vakalarda ve nörolojik semptomları olan hastalarda furosemid ve normal yüksek sodyum diyeti tedavide gereklidir. ADH’nın böbrek toplayıcı kanallar üzerine etkilerini bloke eden demoklosiklin seçilmiş vakalarda 900-1200 mg/24 saat’lik dozda yararlı olabilir.
Çoğu durumda hipernatremi, fazla sodyum alımında çok fazla su kaybına bağlı gelişir. Hipertonik plazma susama hissi için güçlü uyarandır. Beyindeki bir rahatsızlık nedeni ile susuzluk hissini algılayamayanlar veya fiziksel yetersizlik nedeni ile suya ulaşamayan hastalarda hipernatremi gelişir. Çoğu hipernatremik hastalarda bununla birlikte yetersiz serbest su alımıyla birlikte idrarı konsantre etme yeteneğinde primer eksiklik görülür. Su, filtratta fazla miktarda ozmotik olarak aktif partikül varlığında, fazla miktarda elektrolitle birlikte idrarda kaybedilir. Bu tip ozmotik diürez; hiperglisemisi olan hastalarda, mannitol infüzyonundan sonra veya fazla miktarda aminoasit ve üre atılımı olan hastalarda görülür. Bu son durum TPN alanlarda veya tüple beslenip yüksek protein alanlarda görülür. Diabetes insipitus, toplayıcı kanalın suya geçirgen olmadığı bir hastalıktır. Hastalarda ADH salımında santral defekt vardır veya ADH’ya karşı renal cevapta bozukluk mevcuttur (nefrojenik). Ozmotik diürez sonucu oluşan hipernatremide, idrardaki glukoz, mannitol, üre gibi solütlerin varlığı sebebiyle idrar osmolalitesi serum osmolalitesinden yüksektir. Hipovolemi ile birlikte görülen hipernatremide su ile birlikte sodyumda eksiktir ve izotonik tuz infüzyonu gereklidir. Diğer hastalarda hipotonik iv solüsyonlar (%5 dekstroz, yarı-normal tuz, çeyrek-normal tuz çözeltisi) verilmelidir. Bu sıvıların su içerikleri elektrolit konsantrasyonuna göre değişir. Örneğin %5 dekstrozun bir litresi bir litre serbest su içerir çünkü glikoz nihayetinde metabolize edilir. Bununla birlikte yarı-normal tuz veya çeyrek-normal tuz 500 veya 750 ml su içerir. Eğer iv verilecek sıvıya diğer katı paniküller, sözgelimi potasyum, magnezyum eklenirse bunların tonısıteye katkısı göz önüne alınmalıdır. İdrara göre daha hipotonjk olan sıvıların verilmesi hipernatremiyi düzeltir.
İnsan vücudunda yaklaşık olarak 3500mEq potasyum mevcuttur. Normal konsantrasyonu 3.5 ile 5 mEq/L’dir. Hücre dışı sıvı 70 mEq potasyum veya toplam vücut depolarının sadece %2’sini içerir. Diyetle potasyum yüküne karşın yaşamı tehdit eden hiperkalemiden korumak için hücre dışı sıvıdaki potasyumun hızlıca uzaklaştırılması gereklidir. Örneğin homeostatik mekanizmaların yokluğunda, eğer kişi bir öğünde 50 mEq potasyum alırsa (ortalama Amerikan diyeti 100-120 mEq/gün potasyum içerir), serum potasyum değeri 7 mEq/L’ye yükselir (hücre dışı volüm 14L, bazal serum potasyumu 4 mEq/L kabul edilirse). Bu yüzden potasyum yüklenmesine karşı ilk adaptasyon, potasyumun hücre dışı bölgeden hücre içine hızlı dağılımı şeklindedir. İnsülin, aldosteron, katekolarmnler dahil çeşitli hormonlar potasyumun hücre içine hareketine neden olur. Hastanın asit-baz durumu serum potasyum konsantrasyonun diğer bir belirleyicisidir. Hücre ile hücre dışı sıvı arasındaki pH gradyenti potasyumun hücre zarı boyunca hareketini belirler. Serum potasyum konsantrasyonu üzerinde en büyük etki rmneral asitlerin yol açtığı metabolik asidoz ile oluşturulur. Mineral asitlerin anyonlarına karşı hücresel geçirgenlik düşüktür. Sonuç olarak basolateral zar hiperpolarize olur ve potasyumun kana hareketine yol açar. Buna karşın laktik asit ve ketoasitler gibi organik asitleri n sebep olduğu metabolik asidoz hiperkalemiye yol açmaz. Organjk asitlerin anyonlarına karşı göreceli olarak geçirgendir ve hidrojenin hücre içine girmesi eşlik eder. Bu durum potasyumun hücre dışına çıkmasına sebep olan elektrokimyasal gradyenti azaltır. Bu mekanizmalar potasyumun sıvı kompartmanları arasındaki dağılımını etkiiemesine rağmen diğer mekanizmalarda vücuttaki tüm potasyum dengesini sağlamak için gereklidir.
İnsanlar günlük yaklaşık olarak 100 mEq potasyum alır, bunun büyük kısmı böbrekler tarafından elimine edilir. Potasyum atılımında artış, birleştirici tübüIün esas hücreleri tarafından salgılanan potasyumun distal nefronda artması ve toplayıcı kanaldaki tübüler lümen içinde elektrokimyasal gradyentin düşmesinden ileri gelir. Elektrokimyasal farkı arttıran faktörler potasyum sekresyonunu da arttırır. Bu faktörler; distal tübüler sıvının akış oranı, distale sodyumun ulaşımı, tübüler sıvıda geri emilirm zayıf anyonların bulunması ve aldosteron uyarımıdır. Hücre dışı potasyumun hücre içi potasyuma oranı, hücrenin istirahat zar potansiyelini oluşturur. Bu yüzden hiperkalemi veya hipokalemi bu hastalıkların belirti ve bulgularından sorumlu olan istirahat zar potansiyelindeki değişikliklerle birliktedir.
Hastanın diyeti, kullandığı ilaçlar, laksatifler sorgulanarak dikkatli bir öykü alınmalıdır. Gerçek olmayan hiperkalerm ve hipokalemi varsa bu ortaya konulmalıdır. Serum elektrolitleri ve magnezyumun yanı sıra idrar elektrolitIeri ve idrar ozmolalitesi de ölçülmelidir. Bir sonraki basamakta anormal renal potasyum tutulumu hastalığın başlangıcında olup olmadığını saptamak gerekir. Bu da 24 saatlik idrarda potasyum atılımı ölçülerek saptanır. Böbrek kaynaklı hiperkalemide renal potasyum atılımı >20 mEq/gün’den daha fazla olmalıdır. Eğer hipokalemi ekstra renal kayıplar nedeni ile oluyorsa renal potasyum atılımı 20 mEq/gün’den daha az olmalıdır.
Hücre içi potasyum konsantrasyonunun, hücre dışı potasyum konsantrasyonuna oranı istirahat zar potansiyelinin esas belirleyicisidir. Hücre dışı potasyum konsantrasyonu artınca, hücre zarı kısmen depolarize olur, sodyuma olan geçirgenlik azalır ve aksiyon potansiyel oluşturma yeteneği azalır. Bu değişiklikler hiperkalemide kas dokusunda görülen güçsüzlük ve paraliziyi açıklar. Hiperkalemide EKG değişiklikleri görülür. Bu değişiklikler sivri T dalgası, P dalgasının genliğinin azalması veya P dalgası yokluğu, geniş QRS kompleksi, sinüs bradikardisi ve iletim defektieridir. Güç flebotomi tekniği kırmızı kan hücrelerinin parçalanmasına ve bu süreçte hücre içi potasyumun serum örnek içine bırakılmasına neden olur. Trombositoz (>lxıo /!LL) ve lökositozda (>60.000/!lL) gerçek olmayan hiperkalemi görülebilir. Bu hastalıklarda plazma ve serum potasyum konsantrasyonuna hızlıca bakılarak tanı konabilir. Eğer değerde 0,2 mEqIL veya daha az oynama varsa gerçek hiperkalemi mevcuttur. Kronik böbrek yetmezliğinde (KBY) hastalık ilerlemezse, GFR ıo-15ml/dk’nin altına inmedikçe hiperkalemi görülmez. Bu nedenle KBY’ de hiperkalemi bozulmuş GFR’den çok distal nefrondaki potasyum sekresyon defekti nedeni ile oluşur. Kortikotropin veya furosemid verilmesiyle plazma aldosteronunda artış olmaması hiporeninemik hipoaldosteronizmi doğrular. Bu hastalığın patogenezinde, prostaglandin eksikliği rol oynuyor olabilir. Tek doz oral mineralokortikoid (fludrokortizon gibi) verildikten sonra idrar potasyum cevabını değerlendirmek, hipoaldosteronizmi aldosteron rezistansından ayırmada yardımcı olabilir. Aldosteron rezistansında mineralokortikoid verildikten sonra idrar potasyum atılımında hiçbir artış olmaz.
Hiperkalemi tedavisi klinik bulguların önemine bağlıdır. Hiperkalemi ile uyumlu EKG değişiklikleri varsa hiperkaleminin etkisini geri döndürmede en hızlı yöntem normal membran potansiyelini yeniden kurmaktır. Kalsiyum, hiperkaleminin hücre zarı üzerindeki etkilerini antagonize eder ve kardiyak iletim sisteminde hızlı koruma sağlar. Ancak bu koruma kısa sürelidir ve hücre dışı potasyum düzeyinin azaltmak için diğer tedavi yöntemleri birlikte verilmelidir. Sodyum bikarbonat adrenerjik agonist, insülin verilmesi ile potasyum hücre içi kompartmana dağılır ve bu da serum potasyum konsantrasyonunu hızla düşürür. Tedavideki asıl amaç vücuttan potasyumun net olarak uzaklaştırmaktır. Sodyum polisterensülfonat gibi iyon değiştirici reçineler potasyumun gastrointestinal kanaldan atılımını arttırır. Böbrek potasyum atılımını arttırmak için sodyum bikarbonatla distale ulaşan sodyumu düzelterek ve loop diüretikleri verilerek girişimde bulunulabilir. Son olarak hücre dışı fazla potasyumu ortadan kaldırmak için diyaliz yapılabilir.Aldosteron eksikliği olan hastada uzun süreli bir düzenleme için oral mineralokortikoid preparatları kullanılabilir. Önerilen herhangi bir ilaca devam etmemenin hiperkalemiye biraz daha katkıda bulunacağı açıktır.

Potasyum en fazla hücre içi katyon olduğundan, eksikliği birçok duruma sebep olur. Örneğin rabdomiyoliz ve adinamik ileus hipokalemi ile birlikte görülür. Kronik hipokalemi, susama hissini uyarır ve nefrojenik diabetes insipitusa neden olur. Bununla birlikte en belirgin anormallik kardiyovasküler sistemde görülür. Tipik olarak hipokalemide, T dalgası düzleşir ve U dalgaları gelişir. En acil anormallik dijital alan hastalarda görülen aritmidir. Hipokalemi renal amonyak sentezini doğrudan arttırdığından sirozda hepatik ensefalopatiyi kötüleştirebilir. Lökositoz varlığında (>60.000 ceııshıL) gerçek olmayan hiperkalemi olduğu gibi gerçek olmayan hipokalemi de potasyumun serumdan beyaz kan hücrelerine aktif olarak alınması sonucu oluşur. Gerçek hipokalemi yeniden dağılım, böbrek dışı potasyum kaybı, yetersiz alım ve böbrekten potasyum kaybı nedeni ile olur. Toplam vücut potasyumunun sadece %2’si hücre dışı kompartmanda bulunduğundan serum potasyum ölçümü toplam vücut depolarını doğru yansıtmaz. Gerçekten vücuttaki potasyum depoları normalolmasına rağmen hipokalemi görülebilir. Bu durum potasyumun hücre dışı alandan hücre içi alana kayması durumunda görülür. Dolaşımdaki fazla katekolaminler, insülin alımı, alkaloz potasyumun hücre dışından hücre içi bölgeye akışının ana sebeplerindendir. Miyokard enfarktüsü kliniğinde ve KOAH alevlenme döneminde potasyumun bu dağılımındaki değişim önemlidir. Fazla miktarda katekolaminler (stres ve inhaler agonistlere cevap olarak) ve sık diüretik kullanımı nedeni ile toplam vücut potasyumunda azalmayı hazırlayarak potasyumun yer değiştirmesine sebep olması yüzünden bu hastalar aritmilere özelikle eğilimindedirler.
Hipokalemisi olan hastalarda; asit-baz düzeyi, hipertansiyonun olup olmaması, idrar potasyum ve klor düzeylerinin ölçümü tanı ihtimallerinin daraltılması açısından önemlidir. Diüretik kuııanım alışkanlığı olan hastalarda (yeme bozukluğu olan hastalarda) idrar sodyum ve klor konsantrasyonu, metabolik alkaloz varlığında yüksektir. Benzer durum başka nörolojik anormalliklerle, genellikle adölesanlarda görülen ender genetik bir bozukluk olan Bartter sendromunda da görülür ve çıkan kalın koldaki sodyum, potasyum ve klor (NKCC2) kotransportunda aktivite azalması sebep olmaktadır. Bu durumda diüretikIer için idrar incelemesi tanıyı koymak için gereklidir. Gizli kusmaları olan hastalarla karşılaştınldığında idrar klor konsantrasyonu düşüktür. Laksatif alışkanlığı olanlarda metabolik asidoz veya normal asit baz düzeyi ile birlikte düşük idrar sodyum ve klor konsantrasyonu mevcuttur. Meyan kökünün bileşiminde bulunan glisirizik asit, glukokortikoidleri inaktive eden dehidrogenazı bloke eder ve bu inhibisyon distal nefronlardaki mineralokortikoid reseptörlerinin aktivasyonunda regülasyon bozukluğuna neden olur. Hipokalemik hastalarda daima magnezyum düzeyi de ölçülmelidir. Hipomagnezemi ile birlikte görülen hipokalemide magnezyum eksikliği düzeltilmedikçe hipokalemi tedavisine direnç devam eder. Transmembran potasyum akışını belirleyen faktörler göz önüne alındığında net potasyum eksikliğini hesaplamak zordur. 70 kg’ lik bir kişide serum potasyum konsantrasyonu 4mEqIL’den 3mEq/L’ye düştüğünde, toplam vücut potasyumunda 100-200mEq eksilme olur. 3mEqIL’nin altında her ImEqIL serum potasyum konsantrasyonunda azalma, total vücut potasyumunda ek olarak 200-400mEq eksilmeyi gösterir. Hipokalemi tedavisi oral yoldan yapılmalıdır. Aritmisi, dijital toksisitesi olan veya adinamik ileus nedeni ile oral alamayan hastalar gibi acil durumlarda potasyumun intravenöz verilmesi gereklidir. Verilecek iv potasyum genel olarak 10mEq/saat’ i geçmemelidir. Sadece EKG monitörizasyonu altında verilecek potasyum oranı 20mEq/saat’e çıkılabilir. Uzun süre diüretik tedavisi alanlarda gelişen hipokalemi potasyum tutan diüretikler ile tedavi edilir.
Tuz kaybettiren genetik geçişli hastalardaki büyük ilerleme, Bartter ve Gitelman sendromunun distal nefron hücreleri tarafından taşınan spesifik iyon transport proteinlerindeki mutasyondan ileri geldiğinin gösterilmesidir. Gitelman Sendromunda, tiazid duyarlı sodyum klor ko-transportundaki (NCCT) işlev bozukluğu ve Bartter Sendromunda bumetanid duyarlı sodyum potasyum klor (NKCC2) ko-transportundaki disfonksiyon, tuz kaybına, hücre dışı volüm azalmasına, sekonder hiperaldosteronizme ve hipokalemiye sebep olur. Beş ayrı tipi bulunan Bartter Sendromunun ve GiteIman sendromunun değişik karakteristik özellikleri gösterilmiştir. Kısaca Bartter sendromu genetik olarak heterojen bir hastalıktır. Moleküler genetik çalışmalara dayanılarak 5 değişik alt tipinin olduğu saptanmıştır. Tip 1 veya neonatal Bartter Sendromunda, sodyum potasyum klor ko-transporter NKCC2’de mutasyon sonucu fonksiyon kaybı vardır. NKCC2 15. kromozomdaki SCLi2A] geni tarafından kodlanır. Bu sodyum potasyum klor ko-transporter Henle kulbunun kalın çıkan kolundaki (TAL) apikal hücre membranıarı üzerindedir ve normalde glomerül tarafından filtre edilen sodyumun %30’unun geri emiliminden sorumludur. Bu sendromda yaşamın erken dönemlerinde sodyum ve potasyum kaybı ile karakterize şiddetli sistemik hastalık görülür. Polihidroamniyoz, belirgin hiperkalsüri, nefrokalsinoz mevcuttur. Prostoglandin sentezi ve salınımı belirgin olarak artmıştır ve bu da bir çok sistemik semptomu açıklar. Bartter Sendromu Tip II; 12. kromozomdaki KCNJl genindeki mutasyon sonucu fonksiyon kaybı nedeni ile görülür ve bu gen içten düzeltici voltaj bağımlı potasyum kanalı ROMK’u kodlar. Potasyum kanalı ROMK, TAL’da apikal membranda ve kortikal toplayıcı kanallarda bulunur. TAL’da potasyumun bu kanal boyunca renal tübüle akışında, NKCC2 gereklidir ki bunun aktivitesİ için yeterli miktarda luminal potasyuma ihtiyaç vardır.
CCD’de bu kanal diyetteki potasyumun atılımında rol oynar. Bu sendromda atipik ROMK kanalları NKCC2 taşıyıcılarında yetersizliğe neden olur, bu da tuz kaybına, hızlı tübüler akışa ve distalden potasyum kaybına neden olur. Bartter sendrom Tip III’te; 1. kromozomda bulunan klor kanal proteini olan CLC-Kb’yi kod kaybı vardır. Bu protein TAL’ın basolateral hücre membranında bulunur ve sodyum klorun TAL’da geri emiliminden sorumludur. Renal tuz kaybı Bartter Sendromu Tip III’te Tip 1 ve Tip II’ye göre daha hafiftir. Yakın zamanda Bartter Sendromu Tip IV’ün Ip31 kromozomda yer alan BSND (Bartter Sendromu ve sensorinöral işitme kaybı) genindeki mutasyon sonucu oluştuğu bulunmuştur. BSND geni TAL’ın basolateral membranında bulunan “barttin” adındaki proteini kodlar. Barttin; CIC-Kb klor kanalının subünitesidir ve CIC-Kb’nin plazma membranına bırakılması için gereklidir ve kokleada klor kanaııarı CICKa ve CIC-Kb ile birlikte bulunur. Bu hastalarda sodyum potasyum kaybı yanında, bozulmuş koklea fonksiyonu ve sağırlık vardır. Yalu n zamanda Bartter Sendromu Tip V nedeni ile hipokalemik alkalozu olanlarda otozomal dominant hipokalsemi bulunmuştur. Bu hastalıkta hipokalsemi, kalsiyum duyarlı reseptörlerin (CaSR) mutasyonu ile ilişkilendirilmiştir. CaSR; TAL’ın basolateral membranında fazla miktarda bulunur ve hücreler arası sodyum, klor ve kalsiyum transportunu ayarlanmasında önemli inhibitör etkiye sahip olduğu düşünülür. TAL’ın basolateral membranında bulunan CaSR’nin aktivasyonu apikal potasyum kanal aktivitesini düşürür, bu da Bartter benzeri sendromu indükler. Mutasyonlar sonucu gelişen genetik CaSR aktivasyonunun TAL’da paraselüler kalsiyum aluşını sağlayan Iümende pozitif potansiyel fark oluşumunu inhibe ederek, idrar kalsiyum atılımını arttırması beklenir. Gitelman Sendromu moleküler olarak homojen görünmektedir. 16q13 kromozomundaki SLC12A3 genindeki mutasyon sebeplerden biri olarak gösteriIse de, klinik özellikleri Gitelman Sendromunun tersi olan Gordon Sendromunun yalın zamandaki genetik özelliği, muhtemelen birden fazla benzer ayna görüntüsü mutasyonunun Gitelman Sendromunu açıklayabileceği fikrini vermektedir.

SLC12A3 geni böbrekte renal tiazid duyarlı sodyum klor ko-transportunu sağlayan NCCT’yi kodlar. NCCT distal tübülden sodyum geri emiliminden sorumludur, bu da filtre edilen sodyumun yaklaşık %7’sini oluşturur. Gitelman Sendromu, Bartter Sendromuna göre daha hafif olmasına rağmen hastalarda kas şikayetleri, halsizlik ve uzamış QT’si olanlarda aritmiler için risk artışı ile ilgili önemli morbidite bildirilmiştir. Plazma renin aktivitesi artmasına rağmen renal prostaglandin atılımı artmamıştır, bu Gitelman Sendromunu Bartter Sendromundan ayıran bir diğer özelliktir. Bartter ile Gitelman Sendromu arasındaki ana fenotipik fark idrar kalsiyum atılımıdır. Bartter Sendromundaki hiperkalsiüri büyük miktarda çıkan kalın koldaki hücrelerin işlev bozukluğundan kaynaklanır. Luminal potasyum geri dönüşümü ve NKCC2 ko-transportu tarafından üretilen lümen pozitif transepitelyal voltaj, pasif ve paraselüler olan kalsiyum emilimini sağlar. Genetik anomaliler veya loop diüretikler tarafından NKCC2 ko-transportu azaltılır veya bloke edilirse lümendeki pozitiflik ve kalsiyum geri emlimi azalır. Lümen pozitifliğindeki kaybın, magnezyum atılımında artmaya neden yol açmadığı tam olarak netleşmemiştir. Bu mekanizmalara ek olarak TAL’daki disfonksiyon distale ulaşan sodyum klorürde ve hücre içi klor konsantrasyonunda artışa neden olur, bu da distal kıvnmlı tübül (DCT) hücrelerindeki apikal kalsiyum kanallarını inhibe eder ve kalsiyum tutulumuna ve nefrolitiazise sebep olur. Bartter Sendromlu hastaların aksine Gitelman Sendromunda değişmez şekilde hipokalsiüri gözlenir.
Gitelman Sendromundaki hipokalsiüri, DCT diüretiklerinin (tiazid ve diğerleri) idrar kalsiyum atılımını azaltıcı yararlı etkilerine benzer. Gitelman Sendromundaki hipokalsiüri mekanizması iyi anlaşılmıştır. İlk olarak hücre dışı volümdeki hafif azalma proksimal tübüldeki kalsiyum geri emilimini arttırır. İkincisi DCT hücrelerine azalımş Na+ICI+girişi transepitelyal kalsiyum transportunu arttırır. Diüretik tedavisi veya genetik nedenlerle DCT hücrelerine apikal Na ve Ci girişi inhibe edilirse hücre içi klor konsantrasyonu azalır. Azalmış hücre içi klor aktivitesi, hücreyi hiperpolarize eder. DCT hücrelerinde bulunan farklı apikal kalsiyum kanalları olan ECaC ve CaT2 yoluyla kalsiyum girişini aktive eder. Lümenden hücreye doğru olan kalsiyum hareketinin dengelenmesi gerektiğinden, DCT hücrelerine artmış kalsiyum girişi basolateral sodyurnlkalsiyum değiştiricisi ve kalsiyum ATPaz ile kalsiyumun dışarı çıkışını uyarıro Bu yüzden sonuç olarak etki hipokalsiüri gelişimidir. Bartter ve Gitelman Sendromunda kalsiyum ile ilgili bozuklukların patogenezi kısmen açıkken magnezyum ile ilgili bozuklukların patogenezi daha karışıktır. Gitelman Sendromu ciddi hipomagnezemi ile birlikteyken Bartter Sendromunda bu görülmez. Bu sonuç şaşırtıcıdır çünkü magnezyumun Henle kulbu boyunca geri emilimi distal tübüle göre daha fazladır ve hemen verildiğinde DCT diüretikleri loop diüretiklerine göre daha az magnezyum atıIımına sebep olur.
Yakın zamanda ender bir otozomal resesif hastalık olan "hiperkalsiüri ve nefrokalsinoz ile birlikte renal hipomagnezemi’ şeklinde tanımlanan hastalıktan etkilenen ailelerdeki moleküler genetik çalışmalar bir insan geni paracellin- i (PCLN-l) de birçok mutasyonun varlığının keşfine yol açmıştır. Bu gen tarafından kodlanan protein hem TAL’da hem de distal kıvnmlı tübülde fazla sayıda bulunan sıkı bağlantı proteinidir. PCLN-l’ deki mutasyon hipomagnezemi ile birlikte masif renal magnezyum kaybına ve nefrokalsinoz ve böbrek yetmezliği ilesonuçlanan hiperkalsiüriye sebep olur. Bu nedenle çalışmalar, PCLN-l’in tek başına veya diğer bileşenleriyle birlikte hücreler arası por oluşturduğunu, bu pomn magnezyum ve kalsiyumun elektrokimyasal gradyentine göre aşağı bölümlere paraselüler geçişine izin verdiğini düşündürür. PCLN-l’in TAL ve DCT’deki sıkı bağlantılardaki yerleşirni, bu gen mutasyonu olan hastalann fenotip ve magnezyum homeostazında TAL’daki paraselüler yollarla ilgili fizyolojik çalışmalar bu sonucu desteklemektedir. Bu güne kadar magnezyum kaybını Gitelman sendromlu hastalarda oluşturan mekanizma bilinmez olarak kalmıştır.
Endojen asit üretimin en büyük kaynağı, glukoz ve yağ asitlerinin karbondioksit ve suya tam katabolizması ve oksidasyonudur. Hücresel solunum sonucu üretilen günde yaklaşık 22.000mEq hidrojen, karbondioksit olarak uçucu gaz şeklinde akciğerlerden atılır. Sülfür içeren aminoasitlerin metabolizması, fosfoprotein ve fosfolipid oksidasyonu, nükleoprotein yıkımı, karbonhidrat ve yağ asitlerinin yakılması uçucu olmayan asitleri oluşturur. Bu işlemlerle günde yaklaşık 1 mEq/kg hidrojen üretilir. Uçucu olmayan asitlerin atllımJ böbrekler yoluyla olur. Dakikadaki ventilasyon oranındaki değişiklikleri ayarlayan esas faktörler, serebrospinal sıvı ve arteryel kan pH’ ında ki değişikliklerdir. Arter kanındaki normal hidrojen konsantrasyonu 40mEq!L’dir. Bu da 7,40 pH değerine eşittir. Endojen ve ekzojen asit alımındaki değişikliklere rağmen, bu konsantrasyon sabit tutulmaya çalışılır. Dolaşımdaki ve hücre içindeki tamponlar asit yükünü kısa sürede nötralize eder. Ancak bu tamponlama sisteminin kapasitesi kısıtlıdır ve normal endojen asit üretimi tarafından hızlıca tüketilmiş olur. Asit atılımı için mekanizma asit-baz homeostazını sağlamak, bu tampon sistemlerini yeniden oluşturmak için etkili olmalıdır.
Böbrekler glomerüllerden günlük filtre edilen 4500mEq bikarbonatı düzenleyerek ve yeni bikarbonat üreterek asit-baz homeostazına katkıda bulunur. Renal bikarbonat üretimi, net asit atılımı için aşağıdaki denklemde verilmiştir. ENAE = ENH,t + ErA - EHCO-31 ENH~ + ETA amonyum oranını ve titre edilebilir asit oranını gösterir. EHCO:ı’ ise bikarbonat atılım oranıdır. NAE net asİt atılımıdır. Zor olmamasına rağmen, NAE ölçümü rutin yapılamadığından, asit-baz hastalıklannın analizi, hazır ölçümler olduğu halde, indirekt yolla yapılır. Böbrek bikarbonat üretiminde esas işlem idrar asidifikasyonu ve amonyak üretimidir. Amonyak glutaminden üretilir ve proksimal tübül epiteli tarafından tübül sıvısına salınır. Asidifikasyon nefron boyunca dağılmış farklı taşıyıcılardan proton salınımı ile olur. Lümen membranına yerleşmiş olan sodyum hidrojen değiştiricisi Tip 3’ün (NHE3) etkisi ile tübül sıvı pH’sl proksimal tübül boyunca hafifçe düşer. Proton salınımı bikarbonat geri emilimi ile bağlantılıdır ve filtre edilen bikarbonatın yaklaşık %90’1 proksimal tübül boyunca süreç esnasında tübül sıvısından geri emilir. Proksimal tübül, luminal zardaki karbonik anhidrazın varlığına bağlı olarak yüksek bikarbonat geri emilim kapasitesi olan sistem içerir. Lümen membranındaki karbonik anhidraz, karbonik asidin karbondioksit ve suya dehidrasyonunu hızlıca katalize eder, bu da proksimal tübül boyunca tübül pH düşüşünü kısıtlar ve sodyum hidrojen değişimine neden olabilecek çok fazla pH gradyentini önler. Öte yandan distal tübülde luminal karbonik anhidraz eksiktir ve bikarbonat geri emiliminin kısıtlı kapasitesi vardır. Bununla beraber bu bölgeye ulaşan bikarbonat konsantrasyonu düşüktür ve tübül boyunca sıvıda bu bölgedeki esas tampon sistemleri amonyak ve fosfat iyonlandır, distal proton pompasının devamlı çalışması ile bazen idrar pH’sını filtratın başlangıcındaki pH’ya göre 1000 kat düşürür. Bu bölge boyunca asit-baz dengesinde böbreğin bütünüyle çalışması, distal nefron boyunca yerleşmiş olan pompalardan salınan protonlann titre edilmesi ve idrar içine atılması üriner tamponlar olarak gözlenir. Bikarbonat üretimi sabit değildir. Volüm değişikliği, elektralit düzeyi, hormonlar ve asit-baz parametrelerinden etkilenir. Proksimal bikarbonat geri emilimi, volüm azalması ve kronik respiratuar asidoz ve hipokalemi de görüldüğü gibi parsiyel karbondioksit basıncında yükselmenin eşlik ettiği durumlarda artar. Tersine volüm genişlemesi veya PC02’deki düşüş proksimal tübülde bikarbonat geri emjlim oranını düşürür. Aldosteron ve çevredeki
PC02 distal nefron hidrojen iyon salınım oranını etkiler.
İlk basamak arter ve venöz kan örneklerini alıp kan pH ve PC02 düzeylerinin yanısıra serum elektrolitierini ölçerek asit-baz bozukluklarının tipini belirlemektir. Hesaplanmış ve ölçülmüş bikarbonat değerlerinin birbirini tuttuğunun doğrulaması yapılmalıdır. pH, PC02 ve serum bikarbonat düzeyi temel alınarak minimal bir tanı oluşturulmalıdır. Sonra kompansatuar cevap ölçülmeli ve anyon gap hesaplanmalıdır. Eğer primer asit-baz bozukluğunda uygun olmayan kompanzasyon mevcutsa, mikst asit-baz bozukluğundan bahsedilir. Anyon gap, metabolik asidoza tanısal yaklaşım için yararlıdır. Eğer laktik asit gibi organik asit, hücre dışı kompartmana eklenirse asit tamponlandıkça bikarbonat konsantrasyonundaki düşer. Organik baz biriktikçe anyon gap artar. Rakamsalolarak anyon gap’teki artış, bikarbonat konsantrasyonundaki azalmaya eşit olmalıdır. Bu yüzden hesaplanan ve normal anyonik gap arasındaki farkı mevcut olan bikarbonat konsantrasyonuna ekleyerek, başlangıçtaki bikarbonat konsantrasyonu tahmin edilebilir. Anormal biçimde yükselmiş başlangıç bikarbonat konsantrasyonu eşlik eden metabolik alkalozu gösterir. Asit-baz bozukluğunun tipi ve basit yada kompleks olup olmadığı ortaya konulduktan sonra idrar pH’sı, idrar anyon ve osmolar gap’te yararlı bilgiler sağlar.
Metabolik asidoz serum bikarbonat düzeyinde azalma ile karakterizedir. Bu azalma ya bikarbonat içeren sıvıların atılımı ya da bikarbonatın asitleri tamponlamak için kullanımına bağlıdır. Sözü edilen ikincisinde bazın yapısı elektrolit bileşimini etkileyebilir. Bu nedenle metabolik asidozda anyon gap göz önünde bulundurmak faydalıdır. Normal anyonik gap ile birlikte görülen metabolik asidoz, ishalle giden hastalıklarda olduğu gibi çoğu zaman böbrek dışı bikarbonat kaybı sonucu olur, ancak anormal düzeyde fazla bikarbonatın böbreklerden atıldığı durumlarda ve arjinin hidrokloridin verildiğinde olduğu gibi hidroklorik asit oluşumuna neden olan maddeler verildiğinde de görülebilir.Bu eşitlik ölçülen negatif idrar anyon gap ile idrar amonyum salınımı için yaklaşık bir fikir sağlar. Bu yüzden normal renal cevap negatif idrar anyon gap olmalı ve genelliklede bu oran 30-50 mEq/L arasında olmalıdır. Böyle durumlarda asidoz böbrek hasarından çok gastrointestinal kayıplar nedeni ile olur. Artmış anyon gap’e sahip olan asidoz nedenleri açıklanmıştır. Şiddetli böbrek yetmezliğinde, fosfat ve sülfatlar gibi inorganik bileşikler artmış anyon gap’in ana bileşenleridir. Şiddetli böbrek yetmezliğinde organik bileşiklerde birikir. Ketoasidoz, insülinin kısmi veya mutlak eksikliği nedeni ile oluşan ketogenez ve artmış lipoliz nedeni ile oluşur. Alkoliklerde ve uzun süre aç kalanlarda, yetersiz karbonhidrat alımı sonucu baskılanan endojen insülin saIınımı ketoasidoza neden olur. Ek olarak alkolik ketoasidozda insülin direnci keton oluşumuna katkıda bulunur.
Laktik asidoz, bozulmuş hücresel solunum nedeni ile olur. Anaerobik glikoliz sonucu kasta, kırmızı
kan hücrelerinde ve diğer dokularda pirüvatın indirgenmesi ile laktat üretilir. Oksidatif metabolizmanın azaldığı durumlarda da fazla laktik asit üretilir. Bu anaerobik durum ketoasitlerin indirgenmiş forma, 13 hidroksibütirata kayışını sağlar. Asetoasetat ve aseton tarafından katalize edilen nitroprussid reaksiyonu bu nedenle laktik asidozda reaktif değildir. Laktik asidoz çoğunlukla dokulara yeterli oksijenin verilemediği örneğin şok, septisemi, ilerlemiş hipoksemi de görülür. Kimi toksinler mitokondriyel fonksiyonları yeteri düzeyde değiştirir ve efektif anaerobik durum oluşturabilir. Bu toksinlerin bazıları organik asitlere metabolize olarak geniş anyon gap ile karakterize asidoz oluşumuna neden olabilir. Metanol, alkol dehidrogenaz tarafından formik aside metabolize olur. Etilen glikol, glikolik ve oksalik aside metabolize olur. Salisilatların kendileri asidik bileşiklerdir ve artmış anyon gap’li asidoz oluşturabilirler. Metabolik asidozun tedavisi altta yatan sebebe ve belirtilerin şiddetine bağlıdır. pH 7.1’in altında ise ve hasta hemodinamik olarak instabil ise parenteral sodyum bikarbonat hızlıca verilmelidir. Eğer asidoz gastrointestinal bikarbonat kaybı veya renal tübüler asidoz nedeni ile oluşmuşsa oral bikarbonat preparatları ile tedavi yeterli olabilir. Organik asidoz tedavisi altta yatan hastalığa göre yapılmalıdır. Eğer organik asit üretimi durdurulabilirse, organik baz çiftleri metabolize edilebilir, bikarbonat yeniden etkili olarak üretilebilir. Söz gelimi diyabetik ketoasidozdaki asidemi insülin verildiğinde daha fazla keton üretimi inhibe edileceğinden etkili biçimde tedavi edilebilir. Laktik asidozda tedavi doku perfüzyonunu iyileştirici yönde yapılmalıdır. Alkoliklerde ve uzun süre aç kalanlarda oluşan ketoasidoz dektroz içeren iv sıvılar verilerek düzeltilir.
RTA’nın bu ikinci majör grubu teorik olarak esas hücre fonksiyonundaki kayıplardan dolayı olur ve 3 klinik formu vardır. Psödohipoaldosteronizm I, otozomal resesif olarak geçen hiperkalemi, sodyum atılımı ile karakterize bir hastalıktır. Serum aldosteronu yükselmiştir ve hasar mineralokortikoid uygulamasına cevapsızdır. ilk formunda epitelyal sodyum kanalı (ENaC) düşük aktivitelidir ve masif sodyum kaybına sebep olur ve yüksek miktarda oral sodyum alımı ile tedavi edilebilir. Gordon Sendromu olarak adlandırılan ikinci formu hiperkalemi ve sodyum açığı ile karakterizedir, sıklıkla düşük renin ve hafif hipertansiyon eşlik eder. Hasar loop diüretiklerine ve sodyum kısıtlamasına cevap verir. Toplayıcı kanalın yüksek elektriksel gradyent üretme yeteneğini dolaylı olarak değerlendirmek, sodyum geri emilimince oluşturulan negatif transepitelyal potansiyelini düşüren anormal klor geçişi olduğunu akla getirir. Gordon Sendromu distal tübülde sodyum-klor kotransporterini (NCe) inhibe eden tiazid diüretiklerine de duyarlıdır. Son bulgular hiperkalemik RTA’nın bu formunun yeni tanımlanmış bir kinaz olan, NCC fonksiyonunu inhibe eden WNK-4 fonksiyonda kayba neden olan mutasyonun sebep olduğunu desteklemektedir. Bundan dolayı NCC aktivitesi artar, toplayıcı kanala taşımayı düşürür ve potasyum atılımında geçit kaynaklı hasarı arttım. Distal tübülde sodyum geri emilimi arttığından dolayı hiperkalsiüri belirgindir ve nefrokalsinoz görülür. Hiperkalemik RTA’nın üçüncü formu, interstisyel fibrozis ile ilgili edimsel hastalıktır. Bu formda serum aldosteron ve renini hiperkalemi olmasına rağmen düşmüştür. Aldosteron sekresyonundaki bu defektin ve mineralokortikoid uygulamasına duyarsızlığın sebebi bilinmemektedir fakat esas hücre fonksiyonunda kayıpları desteklemektedir. Hastalık furosemide ve hipertansiyonu provoke etmeyecek şekilde dikkatli tuz serbestliğine kısmen yanıt verir.
RTA’nın üçüncü majör sınıfı gradyent limitli formu olarak da adlandırılır ve dış meduller toplayıcı kanalın fonksiyonundaki kaybın sebep olduğu düşünülmektedir. Hem esas hem de ara (interkale) hücre transportları eksiktir. Bu hastalık belirgin bir eşiği (Şek. 27-10) olmayan bikarbonat atılımındaki sabit eksiklik ile karakterizedir. Sıklıkla hastalık hidrojen-ATPaz veya potasyum-hidrojen ATPaz aktivitesindeki kalıtsal eksiklik sebebiyle oluşur. İkincisine karşı edinsel hasar otoimmün hastalıklarda en belirgin olarak da Sjögren sendromunda görülebilir. Bu hasar ayrıca sickle cell hastalığı ve primer hiperparatiroidizmde de interstisyel böbrek hasarıyla birlikte olduklarında görülebilir. Amfoteresin-B ve lityum gibiilaçlar da bu hasara sebep olabilir. Basolateral bant III klor-bikarbonat değiştiricisinin fonksiyon bozukluğu, izole vakalardaki onu kodlayan AEI geninde bulunan mutasyonlarla açıklanmıştır. AEI geninde birden çok mutasyonlar da görülebilmekte ve bu durumlarda RTA ovalositoz ile birliktedir Distal, gradyent-limitli RTA’ların hepsinde hiperkloremik asidoz görülür ve sodyum kaybının sebep olduğu sekonder hiperaldosteronizmin yol açtığı potasyum açığı eşlik eder. Çocuklarda sendrom, gelişimi bozar ve hipokalemik kas paralizi, hiperkalsüri ve nefrokalsinozla birlikte olabilir. Tedavi bikarbonat replasmanı ile beraber potasyum replasmanından oluşur. Özellikle çocuklarda normal gelişmeyi sağlamak için büyük miktarda bikarbonat gerekli olabilir. Distal RTA ciddi nefrokalsinoza yol açan düşük idrar sitrat atılırm da birliktedir.
Bazdaki artış veya asit kaybı ESS’deki bikarbonat konsantrasyonunu arttırır. Normalde serum bikarbonatındaki artış fazla bikarbonatın atılması ile düzeltilir. Metabolik alkaloz olması bikarbonat atılımını düzenleyen böbrek mekanizmasında hasar olduğunu gösterir. Fazla bikarbonatın atılımındaki yetersizlik; özeııikle hiperkapni ve hipokaleminin eşlik ettiği alkaloz veya otonom mineralokortikoid fazlalığında görülen patofizyolojik cevap, volüm azalmasına fizyolojik cevabın görüldüğü her iki durumda oluşabilir. Metabolik alkalozun en sık sebebi kusma ya da mekanik boşaltma yoluyla mideden hidroklorik asit kaybıdır. Diüretik (tiazid veya loop) kuııanımı sıklıkla metabolik alkaloz ile birliktedir. Kusma ve diüretik kullanımı ile ilgili volüm kaybı, proksimal bikarbonat geri emilimini arttırır. Bu alandaki artmış sodyum-hidrojen değişim aktivitesi ve takip eden volüm geri emiliminde artma bikarbonat geri emiliminde artışa sebep olur.Volüm düşüşü aldosteron salgılanmasına yol açar ve bu da distal nefron hidrojen salımını uyarır ve potasyum salınımını arttırır. Bu şartlar altında alkalozun düzeltilmesi sodyum klorür ve potasyum uygulamasını gerektirir. Endojen veya ekzojen mineralokortikoid fazlalığı hücre dışı volüm genişlediği için volüm (sıvı) verilmesine yanıtsızdır. Aldosteron tarafından distal hidrojen salınımının uyarılması, bikarbonat atılımını sınırlandırmaya ve potasyum atılırmnı uyarmaya yeterlidir. Bu bozukluğun düzeltilmesi fazla ınineralokortikoidin atılmasını gerektirir. Tüm bu bozukluklara eşlik eden hipokalemi metabolik alkalozun devam etmesine katkıda bulunur. Fazla alkali alımı (örn., süt-alkali sendromu) metabolik alkalozun nadir nedenidir ve fazla alkali alımında böbrek yetmezliğinin sebep olduğu renal bikarbonat atılımında bozulma sonucu görülür. Bu durumda hiperkalsemi ve D vitamini fazlalığınlO böbrek hasarında birlikte rol aldıkları düşünülmektedir. Alkali uzaklaştırması sıklıkla alkalozu düzeltir fakat nefrokalsinoz kalıcı ise böbrek fonksiyonu düşmeye devam eder. İdrar klor konsantrasyonlarının tespiti, metabolik alkalozun teşhis ve tedavisine rasyonel yaklaşımın belirlenmesinde yardımcıdır. Çocukluktan beri hipertansiyonu olan, alkalozu, hipokalemisi ve düşük idrar kloru olan hastalarda Liddle Sendromu düşünülmelidir. Bu özellikler mineralokortikoid fazlalığına uyabilir fakat renin ve aldosteron seviyeleri baskılanmıştır (psödo hipoaldosteronizm). Proteinin C-terminal bölümünde delesyona sebep olan ENaC genindeki mutasyonla oluşan otozomal resesif geçiş gösteren bir hastalıktır. Bu durum toplayıcı kanaldaki esas hücrelerin luminal zarlarındaki sodyum kanallarında parçalanmasında azalmaya ve yoğunluğunda artışa neden olur. Klinik tablo tuz geri emiliminde artmanın sonucunda, volüm genişlemesi ve distal nefron potasyum ve proton salınımında artmadan ibarettir.
Yüksek idrar kloru ve alkalozu ve hipertansif olan hastalarda hiperkortizolemi araştırılmalıdır, bu primer hiperaldosteronizm ve Cushing hastalığındaki gibi otonom olabileceği gibi, renal arter stenozuna sekonder de olabilir. II-hidroksilaz eksikliği veya belirgin mineralokortikoid fazlalığı (AME) nadir durumlardır. Bu hastalıklarda toplayıcı kanala ulaşan glukokortikoidlerin dönüşümünde azalma, ENaC’nin aşırı uyarılmasına sebep olur. Bir diğer konjenital hipertansiyon ve alkaloz sendromu ise glukokortikoidle düzeltilebilen hiperaldosteronizmdir (GRA-Glucocorticoid remediable aldosteronism). Bu hastalığa II-hidroksilaz genine katkı sağlayan aldosteron sentaz genini yöneten ve adrenokortikoitropik hormon bağımlı aldosteron sentezine yol açan bir genin duplikasyonu sebep olur. Bu durumların her birinde ENaC hiperaktivitesi, sendromun tüm klinik belirtilerine sebep olur. Alkaloz, hipokalemi ve yüksek idrar kloru ile beraber normotansif veya hipotansif durumlar iki farklı şekli vardır: Bartter Sendromu ve Gitelman Sendromu. Her iki sendromda da sodyum klor geri emilimine özel segmentlerde değişik anormalliklerin yanı sıra kalsiyum ve magnezyum atılımında farklar vardır. Bartter Sendromunda kalın çıkan kolda sodyum klor geri emilimini etkileyen genlerde değişik engelleyici mutasyonlarla, NKCC2 ko-transporter’de, ROMK kanalı proteininde ve basolateral klor kanalında fonksiyon kaybettirici mutasyonlar ve kalsiyum algılayıcı reseptörde fonksiyon arttırıcı mutasyonları içerir. Bu mutasyonların her biri artrmş kalsiyum atılımını da içeren tuz kaybına, volüm düşüşüne ve bir çok olguda düşük kan basıncına sebep olur. ESS volümündeki düşme sekonder hiperaldosteronizme sebep olur ve bu durum toplayıcı kanala getirilen sodyum miktarındaki artışla birleşince potasyum kaybına ve artmış proton atılırmna sebep olur. Gitelman Sendromunda distal kıvrımlı tübülde tiazid duyarı sodyum klor ko-transporter’ de engelleyici mutasyonlar tanımlanmıştır. Gitelman Sendromundaki Bartter Sendromundakine zıt olan fenotipik özeııikler sodyum klor ko-transporter’nun inhibisyonunda beklenen azalmış kalsiyum atılımı ve hiperkalsemi gözlenmesidir. Gitelman Sendromundaki hipermagnezürinin sebebi daha az kesindir.
Respiratuar asidoz, alveoler ventilasyonun hızındaki herhangi bir bozulma ile görülür. Akut respiratuar asidoz, respiratuar kasların paralizisi ve hava yolunda tıkanma, solunum merkezinin ani baskılanması (aşırı dozda narkotik) sonucu oluşur. Kronik respiratuar asidoz genellikle kronik hava yolu rahatsızlığı (amfizem), ileri kifoskolyozu, ileri obezitesi (Pickwickian sendromu) olan hastalarda görülür. Serum bikarbonat konsantrasyonu yükselmiştir ve miktarı respiratuar hastalığın ortaya çıkış zamanına ve şiddetine bağlıdır. Uzamış hiperkapnideki (>1 Hafta) serum bikarbonatlOdaki kompansatuar artış primer olarak kemik tamponunun fonksiyonudur ve böbrek artışta daha küçük bir roloynar. PC02’ deki akut artış uyuklama, konfüzyon ve en sonunda karbondioksit narkozuna sebep olur. Asteriks bulunabilir. Karbondioksit serebral vazodilatatör olduğundan dolayı göz dibindeki damarlar çoğunlukla genişlemiş, dolgun ve kıvrımlıdır. İleri hiperkapnik durumu olan hastalarda papil ödemi bulunabilir. Akut respiratuar asidozun pratikteki tek tedavisi altta yatan hastalığın tedavisi ve solunum desteğidir. Kronik hiperkapnisi olup akut PC02 artışı olan hastalarda kronik rahatsızlığı kötüleştirebilecek faktörlerin araştırılmasına dikkat edilmelidir. Diüretikler sıklıkla serum bikarbonatındaki artışı daha da kötüleştirirler ve metabolik alkaloz ve respiratuar asidozlu miks bozukluğa neden olurlar. Bu koşullar altında serumun asidik olması ventilasyonu iyileştirmek için gerekli olabilir.
Respiratuar alkaloz, hiperventilasyonun arteryel PC02’yi düşürmesi ve sonucunda arteryel pH’yı yükseltmesi ile görülür. Akut respiratuar alkaloz en sık gebelik sonucunda görülür, ayrıca respiratuar merkez hasarlarında, akut salisilizmde, ateşli ve septik durumlarda, ileri karaciğer hastalıklarında ve pnömoni, pulmoner emboli ve konjestif kalp yetmezliğinde solunum hızı arttığı zamanlarda da görülebilir. Bozukluk iyatrojenik olarak tedbirsiz mekanik ventilasyon desteği sırasında da ortaya çıkabilir. Yüksek rakımlarda düşük oksijen parsiyelbasıncı nedeniyle ortama alışmak için kronik hiperventilasyon görülür. Akut hiperventilasyon sersemlik, paresteziler, ağız çevresinde uyuşma ve ekstremitelerde karıncalanma ile karakterizedir. İleri olgularda tetani görülür. Hiperventilasyona, anksiyetenin sebep olduğu durumlarda kağıt poşetle tekrar nefes almak akut atağı sonlandırır.